
 .
.
分析 A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,A、B、C、D四种短周期元素,其原子序数依次增大,则A为H元素,B为O元素,B、C同主族且B、C同主族且B的氢化物在常温下呈液态即是水或过氧化氢,则C为S元素,可形成CB2应为SO2,D应为Cl元素,
(1)A2B的电子式,为共价化合物,即水的电子式为: ;
;
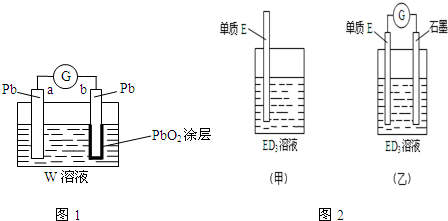
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池;根据电极方程式计算消耗的硫酸,再求出剩余硫酸的浓度;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,Fe与氯化铁反应生成氯化亚铁;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,石墨为正极,Fe3+在正极获得电子生成Fe2+,Fe为负极,发生氧化反应生成Fe2+.
解答 解:(1)A2B的电子式,即水的电子式为: ,故答案为:
,故答案为: ;
;
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池,负极反应为Pb-2e-+SO42-=PbSO4,a极消耗0.05mol Pb,则消耗0.1molH2SO4,
已知溶液体积为1L,且H2SO4的浓度由质量分数39% (密度1.3g/cm3),则1L溶液中n(H2SO4)=$\frac{1000mL×1.3g/mL×39%}{98g/mol}$=5.17mol,
所以剩余的n(H2SO4)=5.07mol,则浓度为5.07mol/L,故答案为:Pb-2e-+SO42-=PbSO4;5.07;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,Fe与氯化铁反应生成氯化亚铁,该反应离子方程式为:Fe+2Fe3+=3Fe2+,故答案为:Fe+2Fe3+=3Fe2+;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,石墨为正极,Fe3+在正极上得电子被还原,电极反应式为:2Fe3++2e-=2Fe2+,没有石墨时氧化还原反应同时在金属Fe上发生,有石墨时,氧化反应和还原反应分别在Fe和石墨上发生.
故答案为:2Fe3++2e-=2Fe2+;使还原反应和氧化反应在电解质溶液中的不同区域内发生.
点评 本题考查元素推断和原电池原理的应用,题目难度中等,注意正确推断元素的种类为解答该题的关键,注意原电池中电解方程式的书写.


科目:高中化学 来源: 题型:解答题
 维生素C又叫抗坏血酸,是一种水溶性维生素,在空气中及高温下易被氧化.碘单质能将其氧化,其结构如所示.
维生素C又叫抗坏血酸,是一种水溶性维生素,在空气中及高温下易被氧化.碘单质能将其氧化,其结构如所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应Mg+2HCl→MgCl2+H2↑+Q(Q>0)分别在20℃和50℃进行 | |
| B. | 颗粒大小同的铁和镁分别与0.1mol/L的硫酸反应 | |
| C. | 同浓度同体积的Na2S2O3溶液分别与同体积的0.1mol/L、0.2mol/L的稀硫酸反应 | |
| D. | 其他条件相同时,硫分别在氧气和空气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; 的系统命名为2,5-二甲基-3-乙基庚烷.
的系统命名为2,5-二甲基-3-乙基庚烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 要提纯的物质 (少量杂质) | 溴乙烷 (乙醇) | 乙醇 (水) | 乙酸乙酯 (乙酸) | 苯 (苯酚) |
| (1)选用试剂 | ||||
| (2)分离方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com