
| A. | 常温常压下,22.4LCO2所含的原子数为3NA | |
| B. | 1molCl2与足量的Fe完全反应,转移的电子数为2NA | |
| C. | 0.5molC2H2和C6H6的气态混合物中所含原子总数为2NA | |
| D. | 2L1mol/L的盐酸中所含HCl分子数约为2NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、氯气和铁反应后变为-1价;
C、C2H2和C6H6中含有的原子个数不同;
D、盐酸溶液中无HCl分子.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故二氧化碳的物质的量小于1mol,则原子个数小于3NA个,故A错误;
B、氯气和铁反应后变为-1价,故1mol氯气反应后转移2mol电子即2NA个,故B正确;
C、C2H2和C6H6中含有的原子个数不同,故0.5mol混合物中含有的原子个数无法计算,故C错误;
D、HCl溶于水后完全电离,故盐酸溶液中无HCl分子,故D错误.
故选B.
点评 本题考查了物质的量和阿伏伽德罗常数的有关计算,难度不大,掌握公式的运用和物质结构特点是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 原子序数B>A>C | B. | 原子最外层电子数C>A>B | ||
| C. | 原子半径A>C>B | D. | 离子半径A+>B2->C3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
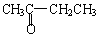
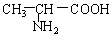 与
与
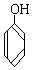 与
与
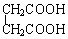 与
与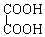
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 先滴加稀盐酸再滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| C | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有K+ |
| D | 滴加NaOH溶液加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解得到的 Cu 的物质的量为 0.5 mol | |
| B. | 向电解后的溶液中加入 98 g 的 Cu(OH)2 可恢复为原溶液 | |
| C. | 原混合溶液中 c(K+)=4 mol/L | |
| D. | 电解后溶液中 c(H+)=2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据元素组成知道它是化合物 | |
| B. | 因为含有钠离子与氯离子和氧离子,所以该物质是盐 | |
| C. | 该物质可以称为钠盐也可以称为次氯酸盐 | |
| D. | 该物质有强氧化性,生活中可用作消毒剂和漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com