
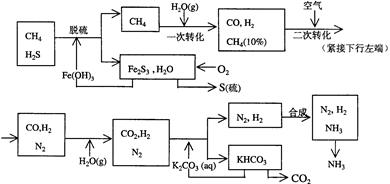
科目:高中化学 来源:不详 题型:填空题
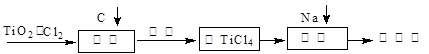
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
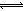 TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
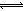 TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
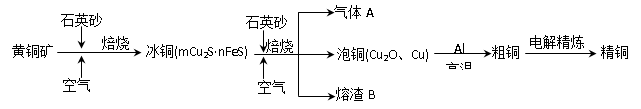
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.减少一次性用品的使用 |
| B.利用太阳能蒸馏海水进行海水的淡化 |
| C.避开公共交通的拥挤,倡导自驾出行 |
| D.海水和淡水交汇处安装半透膜,利用水中电解质浓度的差异进行发电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发 |
| B.铜矿颜色较深,易发现,铝矿颜色较浅,不易发现 |
| C.铜矿较易还原,铝矿很难还原 |
| D.以上说法是错误的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
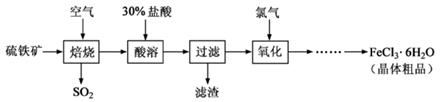
 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com