

分析 (1)反应器中的反应是稀硫酸和NaClO3,通入SO2反应,生成ClO2和NaHSO4,反应为氧化还原反应,注意配平,据此写出反应的化学方程式;
(2)反应过程中SO2主要起还原剂的作用,肯定可以替换SO2的,考虑S的化合价为+4价,据此分析;
(3)①根据装置图分析,与外电源正极连接的电极为阳极,阳极产生Cl2,检验Cl2用湿润的淀粉KI试纸;
②阴极处,通入ClO2,ClO2得到电子,发生还原反应,Na+通过离子交换膜进入阴极参加反应,据此写出电极反应式;
③总反应式ClO2和食盐水在电解池中反应生成Cl2和NaClO2,据此写出总反应式;
(4)吸收器中,ClO2和NaOH和H2O2发生反应,生成NaClO2,H2O2作为还原剂,氧化产物为O2,是一个氧化还原反应,注意配平,据此写出反应的离子方程式;
(5)结晶器中主要是使溶液析出晶体,则操作为蒸发结晶.
解答 解:(1)反应器中的反应是稀硫酸和NaClO3,通入SO2反应,生成ClO2和NaHSO4,反应为氧化还原反应,注意配平,则反应器中生成ClO2的化学方程式是:SO2+2NaClO3+H2SO4=2ClO2+2NaHSO4,
故答案为:SO2+2NaClO3+H2SO4=2ClO2+2NaHSO4;
(2)反应过程中SO2主要起还原剂的作用,肯定可以替换SO2的,考虑S的化合价为+4价,所以肯定可以替换SO2的是Na2SO3,故选③,
故答案为:③;
(3)①根据装置图分析,与外电源正极连接的电极为阳极,阳极产生Cl2,检验Cl2用湿润的淀粉KI试纸,检验方法是:用湿润的KI淀粉试纸接近阳极气体排出口,若变蓝证明有氯气产生,
故答案为:用湿润的KI淀粉试纸接近阳极气体排出口,若变蓝证明有氯气产生;
②阴极处,通入ClO2,ClO2得到电子,发生还原反应生成ClO2-,Na+通过离子交换膜进入阴极参加反应,则阴极反应式是:ClO2+Na++e-=NaClO2,
故答案为:ClO2+Na++e-=NaClO2;
③总反应式ClO2和食盐水在电解池中反应生成Cl2和NaClO2,则总反应方程式是:2ClO2+2NaCl=2NaClO2+Cl2,
故答案为:2ClO2+2NaCl=2NaClO2+Cl2;
(4)吸收器中,ClO2和NaOH和H2O2发生反应,生成NaClO2,H2O2作为还原剂,氧化产物为O2,是一个氧化还原反应,则吸收器中反应的离子方程式是:2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2,
故答案为:2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2;
(5)结晶器中主要是使溶液析出晶体,则操作为蒸发结晶,
故答案为:蒸发结晶.
点评 本题主要考查电解原理,以制取NaClO2为背景,涉及氧化还原反应方程式的书写和配平,电极反应式的书写,明确电解池发生的反应是关键,题目难度中等.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题

 +CH3Cl$\stackrel{AlCl_{3}}{→}$
+CH3Cl$\stackrel{AlCl_{3}}{→}$ +HCl
+HCl .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2?2CO2+3H2O,其工作原理如图所示.下列有关说法正确的是( )
常温常压下,某生物燃料电池(BFC)以乙醇为燃料,直接或间接利用酶作催化剂,其总反应为C2H5OH+3O2?2CO2+3H2O,其工作原理如图所示.下列有关说法正确的是( )| A. | 乙醇发生还原反应 | |
| B. | b极上的电极反应式为O2+4e-+H2O--4OH- | |
| C. | 电池工作时,电解液中的H+由a极向b极迁移 | |
| D. | 当外电路中有1.2 mol电子转移时,能产生4.48 L CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
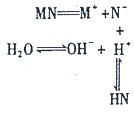
| A. | 该过程可表示MN的水解过程 | B. | 相同条件下结合H+的能力N->OH- | ||
| C. | 该过程使溶液中的c(OH-)>c(H+)] | D. | 溶液中存在c(HN)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列有关它的叙述不正确的是( )
下列有关它的叙述不正确的是( )| A. | 能溶于热水 | |
| B. | 在人体内能水解 | |
| C. | 1 mol对乙酰氨基酚与溴水反应时最多消耗Br22mol | |
| D. | 与对硝基乙苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用0.1000mol/L 的盐酸滴定0.1000mol/L Na2CO3溶液25.00mL.用pH传感器测得混合溶液的pH变化曲线如图.下列说法正确的是( )
常温下,用0.1000mol/L 的盐酸滴定0.1000mol/L Na2CO3溶液25.00mL.用pH传感器测得混合溶液的pH变化曲线如图.下列说法正确的是( )| A. | c→d发生的主要离子反应:HCO3-+H+═H2O+CO2 | |
| B. | 在b点 时,c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | 在d点 时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| D. | 在e点 时完全反应后溶液中水电离出c(H+)=1.0×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=14的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )
25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=14的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )| A. | HA溶液的物质的量浓度为0.0l mol/L | |
| B. | a→b的过程中,混合溶液不可能存在:c(A-)=c(Na+) | |
| C. | b→c的过程中,温度降低的主要原因是溶液中A-发生了水解反应 | |
| D. | 25℃时,HA的电离平衡常数K约为1.25×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由丙烯合成1,2-丙二醇:第一步加成反应,第二步取代反应 | |
| B. | 由1-溴丁烷合成1,3-丁二烯:第一步消去反应,第二步加成反应,第三步消去反应 | |
| C. | 由乙醇合成乙炔:第一步消去反应,第二步加成反应,第三步消去反应 | |
| D. | 由乙烯合成乙二醛:第一步加成反应,第二步取代反应,第三步氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com