
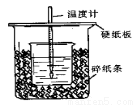
(8分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (偏大、偏小、无影响)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,
所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),
简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(1)、环形玻璃搅拌棒(器)(2)、保温隔热,防止热量散失(3)、偏小
(4)、不相等、相等、中和热指稀的强酸和强碱溶液只生成1摩尔水所放出的热,与酸碱用量无关 (5)、偏小
【解析】
试题分析:(1)为使测量结果更准确,反应必须充分,所以通常用环形玻璃搅拌棒加以搅拌使反应迅速充分反应;(2)为减少实验过程中的热最损失,通常会在烧杯间填满碎纸条,来达到保温、隔热的效果;(3)大烧杯上如不盖硬纸板,热量会有较大损失。求得的中和热数值偏小;
(4)60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液反应生成0.55mol水,而上述实验生成0.50mol水,放出的热量不相等;中和热是指稀溶液中强酸与强碱发生中和反应生成lmol H2O所放出的热量,与酸、碱用量无关。故选相等;(5)氨水属于弱碱,电离需要吸收大量热量,故测得中和热数值会偏小。
考点:考查中和热的测定。


科目:高中化学 来源:2014-2015学年天津市宝坻区四校高一11月联考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.钠与水反应 Na + H2O === Na+ + OH– + H2↑
B.AlCl3溶液中加过量氨水 Al3+ + 3OH– === Al(OH)3↓
C.向氯化亚铁中通入氯气 Fe2+ + Cl2=== Fe3+ + 2Cl–
D.铝粉投入到NaOH溶液2Al + 2OH– + 2H2O===2 AlO2– + 3H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高二上期期中化学试卷(解析版) 题型:填空题
(13分)下表是元素周期表的一部分,表中所列字母分别代表一种化学元素。请用元素符号等化学用语回答下列有关问题:
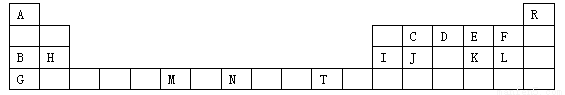
(1)上述元素中第一电离能最大的元素是 ,C、D、E、F四种元素第一电离能由大到小的顺序 。
(2)由A、C、D形成的ACD分子中,σ键个数∶π键个数=________。
(3)要证明太阳上是否含有R 元素,可采用的方法是 。
(4)能够说明K、F两元素非金属性强弱的事实是 ;若欲用一个简单实验证明H、I两种元素金属性的强弱,其实验方法是 。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。已知MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是_____(填“极性”或“非极性”)分子。
(6)C、D两种元素,C的气态氢化物难溶于水,而D的气态氢化物却极易溶于水,
其原因是 。
(7)在元素N的低价硫酸盐溶液中,加入少量由元素G、L、E组成的化合物(原子个数比为1:1:1),观察到的现象是 ;有关反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高二上期期中化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.14g乙烯和丁烯的混合物中含有的原子总数为3NA个
B.标准状况下,22.4L己烷中共价键数目为19NA
C.1mol苯乙烯(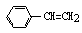 )中含有的C=C数为4NA
)中含有的C=C数为4NA
D.7g CnH2n中含有的氢原子数目为2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏育才中学高二上学期期中化学试卷(解析版) 题型:实验题
(4分)在25℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸溶液用该NaOH溶液中和,需VbL NaOH溶液,(题中a≤b,b≥8)。问:
(1)若a+b=14,则Va/Vb= .
(2)若a+b=13,则Va/Vb=
(3)若a+b>14,则Va/Vb= ,且Va Vb(填“>”“<”“=”)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏育才中学高二上学期期中化学试卷(解析版) 题型:选择题
室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,叙述错误的是
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏育才中学高二上学期期中化学试卷(解析版) 题型:选择题
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏省高二上学期期中考试化学试卷(解析版) 题型:选择题
氮化硼是一种新合成的结构材料,它是超硬、耐磨,耐高温的物质,下列各组物质熔化时所克服的粒子间的作用与氮化硼熔化时所克服的粒子间作用相同的是
A.C60和金刚石 B.晶体硅和水晶
C.冰和干冰 D.碘和金刚砂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏回族自治区银川一中高一上期中化学试卷(解析版) 题型:选择题
在相同的温度和压强下,二氧化氮和二氧化碳两种气体的分子数相同,则下列它们的( )一定相同。
(1)体积 (2)所含原子个数 (3)物质的量 (4)质量 (5)密度
A.只有(1)(2)(3) B.只有(1)(2)(4)
C.只有(2)(3)(5) D.(1)(2)(3)(4)(5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com