
|
现有NO2、O2的混合气体12 mL,通入足量水中,充分反应后逸出气体2 mL(同温同压下),则原混合气体中含氧气的体积是( ). | |
A. |
1.2 mL |
B. |
2.4 mL |
C. |
3 mL |
D. |
4 mL |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解

 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源:2010届江苏启东中学高三考前辅导训练化学试题 题型:计算题
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
⑴某温度下,SO2(g)+1/2O2(g)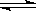 SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。恒温下,若往容器中再加入4mol SO2(g),则重新达到平衡时SO2的总转化率 原平衡时SO2转化率(选填“>”、“<”或“=”)。
SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。恒温下,若往容器中再加入4mol SO2(g),则重新达到平衡时SO2的总转化率 原平衡时SO2转化率(选填“>”、“<”或“=”)。
⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。试写出总反应方程式:
,现有1L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4L,则混和气体中NO2、NO的物质的量之比为 。
⑶ 硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(未配平)来制取单质I2。NaIO3来源于自然界的矿物。
①NaIO3+NaHSO3—NaI+Na2SO4+H2SO4
②IO3-+I-+H+—I2+H2O
在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。请计算开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是______.
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是______.查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
⑴某温度下,SO2(g)+1/2O2(g)![]() SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。恒温下,若往容器中再加入4mol SO2(g),则重新达到平衡时SO2的总转化率 原平衡时SO2转化率(选填“>”、“<”或“=”)。
SO3(g);△H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。恒温下,若往容器中再加入4mol SO2(g),则重新达到平衡时SO2的总转化率 原平衡时SO2转化率(选填“>”、“<”或“=”)。
⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。试写出总反应方程式:
,现有1L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4L,则混和气体中NO2、NO的物质的量之比为 。
⑶ 硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(未配平)来制取单质I2。NaIO3来源于自然界的矿物。
①NaIO3+NaHSO3—NaI+Na2SO4+H2SO4
②IO3-+I-+H+—I2+H2O
在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。请计算开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com