
”¾ĢāÄæ”æŌŚ1.0 LŗćČŻĆܱÕČŻĘ÷ÖŠ·ÅČė0.10 mol X£¬ŌŚŅ»¶ØĪĀ¶ČĻĀ·¢Éś·“Ó¦£ŗX(g)![]() Y(g)£«Z(g) ¦¤H£¼0£¬ČŻĘ÷ÄŚĘųĢå×ÜŃ¹ĒæpĖę·“Ó¦Ź±¼ätµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£ŅŌĻĀ·ÖĪöÕżČ·µÄŹĒ ( )
Y(g)£«Z(g) ¦¤H£¼0£¬ČŻĘ÷ÄŚĘųĢå×ÜŃ¹ĒæpĖę·“Ó¦Ź±¼ätµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£ŅŌĻĀ·ÖĪöÕżČ·µÄŹĒ ( )
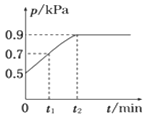
A. øĆĪĀ¶ČĻĀ“Ė·“Ó¦µÄĘ½ŗā³£ŹżK£½3.2
B. “Ó·“Ó¦æŖŹ¼µ½t1Ź±µÄĘ½¾ł·“Ó¦ĖŁĀŹv(X)£½0.2/t1 mol”¤L£1”¤min£1
C. ÓūĢįøßĘ½ŗāĢåĻµÖŠYµÄ°Ł·Öŗ¬Į棬æɼÓČėŅ»¶ØĮæµÄX
D. ĘäĖūĢõ¼ž²»±ä£¬ŌŁ³äČė0.1 molĘųĢåX£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬XµÄ×Ŗ»ÆĀŹ¼õÉŁ
”¾“š°ø”æD
”¾½āĪö”æ
X(g)![]() Y(g)£«Z(g)
Y(g)£«Z(g)
æŖŹ¼ 0.1 0 0
񄯒 b b b
t1minĩ 0.1-b b b
øł¾ŻŃ¹Ēæ±ČµČÓŚĪļÖŹµÄĮæ±Č£¬![]() £¬b=0.04£»
£¬b=0.04£»
X(g)![]() Y(g)£«Z(g)
Y(g)£«Z(g)
æŖŹ¼ 0.1 0 0
×Ŗ»Æ a a a
Ę½ŗā 0.1-a a a
øł¾ŻŃ¹Ēæ±ČµČÓŚĪļÖŹµÄĮæ±Č£¬![]() £¬a=0.08”£
£¬a=0.08”£
A. øĆĪĀ¶ČĻĀ“Ė·“Ó¦µÄĘ½ŗā³£ŹżK£½![]() 0.32£¬¹ŹA“ķĪó£»
0.32£¬¹ŹA“ķĪó£»
B. “Ó·“Ó¦æŖŹ¼µ½t1Ź±µÄĘ½¾ł·“Ó¦ĖŁĀŹv(X)![]() £½0.04/t1 mol”¤L£1”¤min£1£¬¹ŹB“ķĪó£»
£½0.04/t1 mol”¤L£1”¤min£1£¬¹ŹB“ķĪó£»
C.ĻņĢåĻÖÖŠ¼ÓČėŅ»¶ØĮæµÄX£¬Ļąµ±ÓŚ¼ÓŃ¹£¬YµÄ°Ł·Öŗ¬Įæ¼õŠ”£¬¹ŹC“ķĪó£»
D. ĘäĖūĢõ¼ž²»±ä£¬ŌŁ³äČė0.1 molĘųĢåX£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬ µ«¶ŌÓŚXµÄ×Ŗ»ÆĀŹ£¬Ļąµ±ÓŚ¼ÓŃ¹£¬XµÄ×Ŗ»ÆĀŹ¼õÉŁ£¬¹ŹDÕżČ·”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ»śĪļZŹĒÖʱøŅ©ĪļµÄÖŠ¼äĢ壬ŗĻ³ÉZµÄĀ·ĻßČēĻĀĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲŠšŹö²»ÕżČ·µÄŹĒ
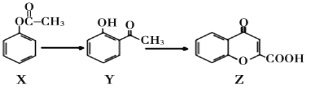
A. XµÄ·Ö×ÓŹ½ĪŖC8H8O2
B. X”¢Y”¢Z¾łÄÜŗĶNaOHČÜŅŗ·“Ó¦
C. æÉÓĆNaHCO3ČÜŅŗ¼ų±šYŗĶZ
D. 1mol Xøś×ćĮæH2·“Ó¦£¬×ī¶ąĻūŗÄ4mol H2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×ĶéČ¼ÉÕŹ±µÄÄÜĮæ±ä»ÆČēĶ¼£¬ÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø £©

A.Ķ¼1ÖŠ·“Ó¦ĪŖ£ŗCH4(g)+2O2(g)=CO2(g)+2H2O(l) H=+890.3kJ/mol
B.Ķ¼2ÖŠ·“Ó¦ĪŖ£ŗCH4(g)+![]() O2(g)=CO(g)+2H2O(g) H=©607.3kJ/mol
O2(g)=CO(g)+2H2O(g) H=©607.3kJ/mol
C.ÓÉĶ¼æÉŅŌĶĘµĆ£ŗCO(g)+![]() O2(g)=CO2(g) H=©283kJ/mol
O2(g)=CO2(g) H=©283kJ/mol
D.ÓÉĶ¼æÉŅŌĶĘÖŖ£ŗµČĪļÖŹµÄĮæµÄCO2ŗĶCO£¬CO2¾ßÓŠµÄÄÜĮæøß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”涞Ńõ»Æ¹č¹ć·ŗ“ęŌŚÓŚ×ŌČ»½ēÖŠ£¬ŌŚČÕ³£Éś»ī”¢Éś²ś”¢æĘŃŠ¼°ŠĀŠĶ²ÄĮĻµČ·½ĆęÓŠ×ÅÖŲŅŖµÄÓĆĶ¾”£a”«eŹĒ¶Ō¢Ł”«¢Ż·“Ó¦ÖŠSiO2Ėł±ķĻֵĻÆѧŠŌÖŹ»ņ×÷ÓĆ½ųŠŠÅŠ¶Ļ£¬ĘäÖŠÕżČ·µÄŹĒ
¢ŁSiO2+2NaOH£½Na2SiO3+H2O
¢ŚSiO2+2C![]() Si+2CO”ü
Si+2COӟ
¢ŪSiO2+4HF£½SiF4”ü+2H2O
¢ÜNa2CO3+SiO2![]() Na2SiO3+CO2”ü
Na2SiO3+CO2ӟ
¢ŻSiO2+3C![]() SiC+2CO”ü
SiC+2COӟ
a.·“Ó¦¢ŁÖŠSiO2×÷ĪŖ²£Į§µÄ³É·Ö±»ĻūŗÄ£¬ÓĆÓŚæĢŹ“²£Į§
b.·“Ó¦¢ŚÖŠSiO2±ķĻÖ³öŃõ»ÆŠŌ
c.·“Ó¦¢ŪÖŠSiO2±ķĻÖĮĖĖįŠŌŃõ»ÆĪļµÄĶØŠŌ
d.·“Ó¦¢Ü·ūŗĻÓĆÄѻӷ¢ŠŌµÄĖįōūÖĘČ”Ņ×»Ó·¢ŠŌµÄĖįōūµÄµĄĄķ
e.·“Ó¦¢ŻÖŠSiO2Ī“²Ī¼ÓŃõ»Æ»¹Ō·“Ó¦
A.aceB.bdeC.cdeD.ab
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĶ²»ÄÜÓėĻ”ĮņĖįÖ±½Ó·“Ó¦£¬±¾ŹµŃéÖŠ½«ŹŹĮæÅØĻõĖį·Ö¶ą“Ī¼ÓČėµ½Ķ·ŪÓėĻ”ĮņĖįµÄ»ģŗĻĪļÖŠ£¬¼ÓČČŹ¹Ö®·“Ó¦ĶźČ«£¬ĶعżÕō·¢”¢½į¾§æÉÖʵĆĮņĖįĶ¾§Ģå(×°ÖĆČēĶ¼1”¢2ĖłŹ¾)”£


(1)°ŃÅØĻõĖį·Ö¶ą“Ī¼ÓČėµ½Ķ·ŪÓėĻ”ĮņĖįµÄ»ģŗĻĪļÖŠµÄÄæµÄŹĒ_______________”£
(2)Ķ¼1ÉÕĘæÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_____________________________________”£
(3)Ķ¼2ŹĒĶ¼1µÄøĽų×°ÖĆ£¬ĘäÓÅµć³żæÉŅŌ·ĄÖ¹µ¹ĪüĶā»¹ÓŠ£ŗ____________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŅ“¼ŹĒÖŲŅŖµÄÓŠ»ś»Æ¹¤ŌĮĻ£¬æÉÓÉŅŅĻ©Ė®ŗĻ·ØÉś²ś£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ČēĻĀ£ŗC2H4(g)+ H2O(g)![]() C2H5OH(g)£¬ĻĀĶ¼ĪŖŅŅĻ©µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č(T)”¢Ń¹Ēæ(P)µÄ¹ŲĻµ[ĘšŹ¼n(C2H4)”Ćn(H2O) =1”Ć1]”£ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ
C2H5OH(g)£¬ĻĀĶ¼ĪŖŅŅĻ©µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č(T)”¢Ń¹Ēæ(P)µÄ¹ŲĻµ[ĘšŹ¼n(C2H4)”Ćn(H2O) =1”Ć1]”£ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ
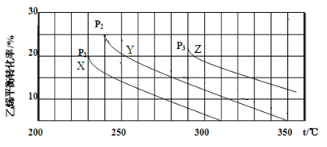
A. Y¶ŌÓ¦µÄŅŅ“¼µÄÖŹĮæ·ÖŹżĪŖ1/9
B. X”¢Y”¢Z¶ŌÓ¦µÄ·“Ó¦ĖŁĀŹ£ŗ¦Ō(X) > ¦Ō(Y) > ¦Ō(Z)
C. X”¢Y”¢Z¶ŌÓ¦µÄĘ½ŗā³£ŹżŹżÖµ£ŗKX > KY > KZ
D. Ōö“óŃ¹Ēæ”¢ÉżøßĪĀ¶Č¾łæÉĢįøßŅŅĻ©µÄĘ½ŗā×Ŗ»ÆĀŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×ĖįŹĒ»ł±¾ÓŠ»ś»Æ¹¤ŌĮĻÖ®Ņ»£¬¹ć·ŗÓĆÓŚÅ©Ņ©”¢Ę¤øļ”¢Č¾ĮĻ”¢Ņ½Ņ©ŗĶĻš½ŗµČ¹¤Ņµ”£
£Ø1£©ŅŃÖŖČČ»Æѧ·“Ó¦·½³ĢŹ½£ŗ
I:HCOOH(g)![]() CO(g)+H2O(g) ”÷H1=+72.6kJmol£1£»
CO(g)+H2O(g) ”÷H1=+72.6kJmol£1£»
II£ŗ2CO(g)+O2(g)![]() 2CO2(g) ”÷H 2=£566.0kJmol£1£»
2CO2(g) ”÷H 2=£566.0kJmol£1£»
III£ŗ2H2(g)+O2(g)![]() 2H2O(g) ”÷H 3=£483.6kJmol£1
2H2O(g) ”÷H 3=£483.6kJmol£1
Ōņ·“Ó¦IV£ŗCO2(g)+H2(g)![]() HCOOH(g)µÄ”÷H =____________kJmol£1”£
HCOOH(g)µÄ”÷H =____________kJmol£1”£
£Ø2£©²éŌÄ׏ĮĻÖŖŌŚ¹ż¶É½šŹō“߻ƼĮ“ęŌŚĻĀ£¬CO2(g)ŗĶH2 (g)ŗĻ³ÉHCOOH(g)µÄ·“Ó¦·ÖĮ½²½½ųŠŠ:µŚŅ»²½:CO2(g)+H2(g)+M(s)”śMHCOOH(s)£»µŚ¶ž²½:___________________”£
¢ŁµŚŅ»²½·“Ó¦µÄ”÷H _________0(Ģī”°>”±»ņ”°<”±)”£
¢ŚµŚ¶ž²½·“Ó¦µÄ·½³ĢŹ½ĪŖ________________________”£
¢ŪŌŚĘšŹ¼ĪĀ¶Č”¢Ģå»ż¶¼ĻąĶ¬µÄ¼×”¢ŅŅĮ½øöĆܱÕČŻĘ÷ÖŠ·Ö±šĶ¶ČėĶźČ«ĻąĶ¬µÄH2(g)ŗĶCO2(g)£¬¼×ČŻĘ÷±£³ÖŗćĪĀŗćČŻ£¬ŅŅČŻĘ÷±£³Ö¾ųČČŗćČŻ£¬¾²ā¶Ø£¬Į½øöČŻĘ÷·Ö±šŌŚt1”¢t2Ź±æĢĒ”ŗĆ“ļµ½Ę½ŗā£¬Ōņt1_________t2(Ģī”°>”±”¢”°<”±»ņ”°=”±)”£
£Ø3£©ŌŚĢå»żĪŖ1LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬ĘšŹ¼Ķ¶ĮĻn(CO2)=1mol£¬ŅŌCO2(g)ŗĶH2(g)ĪŖŌĮĻŗĻ³ÉHCOOH(g)£¬HCOOHĘ½ŗāŹ±µÄĢå»ż·ÖŹżĖęĶ¶ĮĻ±Č£Ū £ŻµÄ±ä»ÆČēĶ¼ĖłŹ¾£ŗ
£ŻµÄ±ä»ÆČēĶ¼ĖłŹ¾£ŗ

¢ŁĶ¼ÖŠT1”¢T2±ķŹ¾²»Ķ¬µÄ·“Ó¦ĪĀ¶Č£¬ÅŠ¶ĻT1____________T2(Ģī”°”µ”±”¢”°<”±»ņ”°=”± ) £¬ŅĄ¾ŻĪŖ____________________”£
¢ŚĶ¼ÖŠa=______________”£
¢ŪA”¢B”¢CČżµćCO2£Øg£©µÄĘ½ŗā×Ŗ»ÆĀŹ¦ĮA”¢¦ĮB”¢¦ĮCÓɓ󵽊”µÄĖ³ŠņĪŖ____________”£
¢ÜT1ĪĀ¶ČĻĀ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK=______________£Ø¼ĘĖć½į¹ūÓĆ·ÖŹż±ķŹ¾£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ”×éŌŚFe2+¼ģŃ鏵ŃéÖŠ¹Ū²ģµ½Ņģ³£ĻÖĻó£¬ĪŖĢ½¾æ”°ŗģÉ«ĶŹČ„”±µÄŌŅņ£¬½ųŠŠČēĻĀŹµŃé£ŗ
±ąŗÅ | ŹµŃéI | ŹµŃéII | ŹµŃéIII |
ŹµŃé²½Öč |
| ½«ŹµŃéIĶŹÉ«ŗóµÄČÜŅŗ·ÖČż·Ż·Ö±š½ųŠŠŹµŃé
| ĪŖ½ųŅ»²½Ģ½¾æ”°ŗģÉ«ĶŹČ„”±µÄŌŅņ£¬ÓÖ½ųŠŠŅŌĻĀŹµŃé ¢Ł ¢ŚČ”·“Ó¦ŗóµÄČÜŅŗ£¬µĪ¼ÓŃĪĖįŗĶBaCl2ČÜŅŗ |
ĻÖĻó | ČÜŅŗĻȱäŗģ£¬Ę¬æĢŗóŗģÉ«ĶŹČ„£¬ÓŠĘųĢåÉś³É£Ø¾¼ģŃéĪŖO2£© | ¢ŁĪŽĆ÷ĻŌĻÖĻó ¢ŚČÜŅŗ±äŗģ ¢Ū²śÉś°×É«³Įµķ | ¢ŁČÜŅŗ±äŗģ£¬Ņ»¶ĪŹ±¼äŗó²»ĶŹÉ«”£ ¢ŚĪŽ°×É«³Įµķ²śÉś |
·ÖĪöÉĻŹöČżøöŹµŃ飬ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ
A.ŌŚ“ĖŹµŃéĢõ¼žĻĀH2O2Ńõ»ÆFe2£«µÄĖŁĀŹ±ČŃõ»ÆSCN£µÄĖŁĀŹæģ
B.ĶعżŹµŃé¢ņĶĘ³öŹµŃé¢ńÖŠŗģÉ«ĶŹČ„µÄŌŅņŹĒÓÉÓŚSCN£±»Ńõ»Æ
C.ĶعżŹµŃé¢ńŗĶŹµŃé¢ó¶Ō±ČĶĘ³öŗģÉ«ĶŹČ„Ö»ÓėH2O2µÄŃõ»ÆŠŌÓŠ¹Ų
D.×ŪÉĻĖłŹö£¬ŹµŃé¢ńÖŠŗģÉ«ĶŹČ„µÄŌŅņÓė»ÆŃ§Ę½ŗāŅʶÆŌĄķĪŽ¹Ų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬½«NH3 ĶØČė50 mL NH4Cl ČÜŅŗÖŠÖĮpH=10£¬ŌŁĻņĘäÖŠµĪ¼Ó1 mol/LŃĪĖį”£ČÜŅŗµÄpHĖę¼ÓČėŃĪĖįĢå»żµÄ±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ

A.a µćČÜŅŗÖŠ£¬c(OH-) = 1”Į10-4mol/LB.b µćČÜŅŗÖŠ£¬c(![]() ) > c(Cl-)
) > c(Cl-)
C.a”śb£¬Ė®µÄµēĄė³Ģ¶Č¼õŠ”D.c µćŹ±£¬¼ÓČėµÄ n(HCl)Š”ÓŚĶØČėµÄ n(NH3)
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com