
| X溶液 | 现象 | 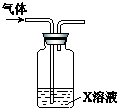 | |
| A | 紫色石蕊溶液 | 溶液先变红后褪色 | |
| B | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
| C | 滴有KSCN的FeSO4溶液 | 溶液变为红色 | |
| D | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 实验证明该气体只含有O2、Cl2、HCl和水蒸气,存在氯气时,与水反应生成盐酸和HClO,溶液具有酸性和漂白性,以此来解答.
解答 解:A.由现象可知,褪色说明存在HClO,即气体中含氯气,故A选;
B.氧气可氧化KI,溶液变蓝,不能说明含氯气,故B不选;
C.氧气可氧化亚铁离子,溶液变为红色,不能说明含氯气,故C不选;
D.HCl可与硝酸银反应生成白色沉淀,不能说明含氯气,故D不选;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、现象与结论的关系为解答的关键,侧重分析与实验能力的考查,注重元素化合物知识与实验相结合的训练,注意氧化还原反应的判断,题目难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:解答题
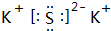 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ab}{22400}$mol•L-1 | B. | $\frac{ab}{22400+17a}$mol•L-1 | ||
| C. | $\frac{1000ab}{22400+35a}$mol•L-1 | D. | $\frac{1000ab}{22400+17a}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
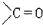 +RMgX→
+RMgX→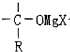 $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$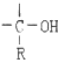
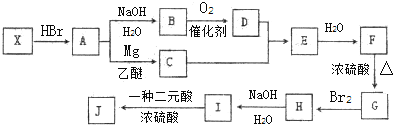
 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
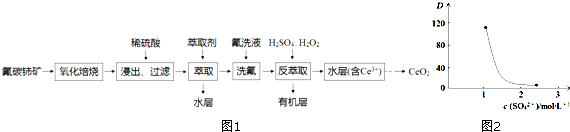
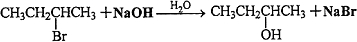
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13 | B. | 14 | C. | 15 | D. | 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com