
【题目】根据下图,回答问题。
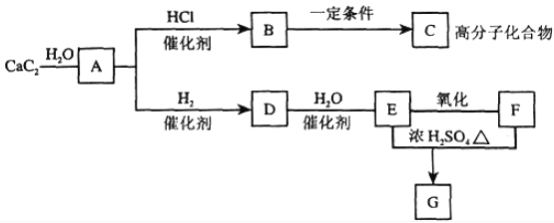
(1)有机物C的结构简式:________。
(2)①反应DE的化学方程式是_____________。
②E和F反应生成G的化学方程式是__________,反应类型为_________。
③实验室制取A的化学方程式__________。
【答案】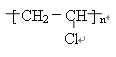 CH2=CH2+H2O
CH2=CH2+H2O![]() CH3CH2OH CH3COOH+CH3CH2OH
CH3CH2OH CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 酯化反应(或取代反应) CaC2+2H2O→CH≡CH↑+Ca(OH)2
CH3COOCH2CH3+H2O 酯化反应(或取代反应) CaC2+2H2O→CH≡CH↑+Ca(OH)2
【解析】
由有机物的转化关系可知,CaC2与水反应生成氢氧化钙和乙炔,则A为乙炔;乙炔在催化剂作用下与HCl发生加成反应生成CH2=CHCl,则B为CH2=CHCl;CH2=CHCl一定条件下发生加聚反应生成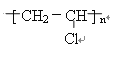 ,则C为
,则C为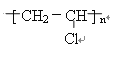 ;乙炔在催化剂作用下与H2发生加成反应生成CH2=CH2,则D为CH2=CH2;CH2=CH2在催化剂作用下与H2 O发生加成反应生成CH3CH2OH,则E为CH3CH2OH;CH3CH2OH催化氧化生成CH3COOH,则F为CH3COOH;在浓硫酸作用下,CH3CH2OH和CH3COOH发生酯化反应生成CH3COOCH2CH3,则G为CH3COOCH2CH3。
;乙炔在催化剂作用下与H2发生加成反应生成CH2=CH2,则D为CH2=CH2;CH2=CH2在催化剂作用下与H2 O发生加成反应生成CH3CH2OH,则E为CH3CH2OH;CH3CH2OH催化氧化生成CH3COOH,则F为CH3COOH;在浓硫酸作用下,CH3CH2OH和CH3COOH发生酯化反应生成CH3COOCH2CH3,则G为CH3COOCH2CH3。
(1)有机物C聚氯乙烯,结构简式为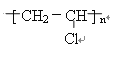 ,故答案为:
,故答案为: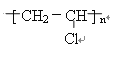 ;
;
(2)①反应DE为CH2=CH2在催化剂作用下与H2 O发生加成反应生成CH3CH2OH,反应的化学方程式为CH2=CH2+H2O![]() CH3CH2OH,故答案为:CH2=CH2+H2O
CH3CH2OH,故答案为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
②E和F反应生成G的反应为在浓硫酸作用下,CH3CH2OH和CH3COOH发生酯化反应生成CH3COOCH2CH3,反应的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;酯化反应(或取代反应);
CH3COOCH2CH3+H2O;酯化反应(或取代反应);
③实验室用电石和乙炔反应制取乙炔,反应的化学方程式为CaC2+2H2O→CH≡CH↑+Ca(OH)2,故答案为:CaC2+2H2O→CH≡CH↑+Ca(OH)2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
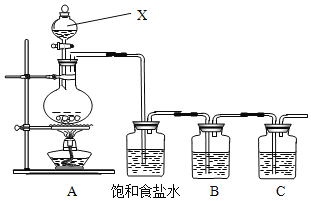
(1)请写出A装置中发生反应的化学方程式___。
(2)饱和食盐水的作用是_____。
(3)装置B中盛放的试剂是___(选填下列所给试剂的编号),反应离子方程式是__。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置C中盛放的是烧碱溶液,目的是:______________________
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强_____(填编号)
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④HCl酸性比H2S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(6)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CCl4,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T,R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T型化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示。下列推断正确的是( )
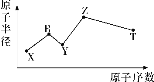
A.原子半径和离子半径均满足:Y<Z
B.简单氢化物的沸点和热稳定性均满足:Y>T
C.最高价氧化物对应的水化物的酸性:T<R
D.常温下,0.1mol·L-1由X、Y、Z、T四种元素组成的化合物的水溶液的pH一定大于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A C60和石墨 B 126C和136C C 冰醋酸和乙酸 D CH3CHO与![]() E 甲烷和十二烷 F 乙醇和乙二醇
E 甲烷和十二烷 F 乙醇和乙二醇
①互为同位素的是_________;
②互为同系物的是___________;
③互为同分异构体的是________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族, D、E同周期。A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18。F是其所在周期中最活泼的金属元素。根据推断回答下列问题:
(1)A在周期表中的位置_____;写出A单质的电子式________。
(2)用“>”或“<”填空:
离子半径 | 非金属性 | 酸性 | 氢化物的稳定性 |
F+_D2— | A_B | D的最高价氧化物的水化物___E的最高价氧化物的水化物 | C的氢化物__E的氢化物 |
(3)—定条件,在水溶液中1molE-、![]() (x=1,2,3,4)的能量(KJ)相对大小如图所示。
(x=1,2,3,4)的能量(KJ)相对大小如图所示。
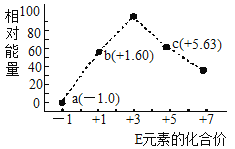
①c点对应的微粒是_______(填离子符号)。
②b→a+c反应的离子方程式为________,该反应是______反应(填“吸热”或“放热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种常见的化工产品,它在纺织、印染、医药、化工、电镀以及木材和纸张的防腐等方面有极其广泛的用途。实验室制备硫酸铜的步骤如下:
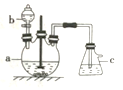
①在仪器a中先加入20g铜片、60 mL水,再缓缓加入17 mL浓硫酸:在仪器b中加入39 mL浓硝酸;在仪器c中加入20%的石灰乳150 mL。
②从仪器b中放出约5mL浓硝酸,开动搅拌器然后采用滴加的方式逐渐将浓硝酸加到仪器a中,搅拌器间歇开动。当最后滴浓硝酸加完以后,完全开动搅拌器,等反应基本停止下来时,开始用电炉加热直至仪器a中的红棕色气体完全消失,立即将导气管从仪器c中取出,再停止加热。
③将仪器a中的液体倒出,取出未反应完的铜片溶液冷却至室温.析出蓝色晶体.回答下列问题:
(1)将仪器b中液体滴入仪器a中的具体操作是__________。
(2)写出装置a中生成CuSO4的化学方程式:_______。
(3)步骤②电炉加热直至仪器a中的红棕色气体完全消失,此时会产生的气体是______,该气体无法直接被石灰乳吸收,为防止空气污染,请画出该气体的吸收装置(标明所用试剂及气流方向)______。
(4)通过本实验制取的硫酸铜晶体中常含有少量Cu(NO3)2,可来用重结晶法进行提纯,检验Cu(NO3)2是否被除净的方法是_______。
(5)工业上也常采用将铜在450 °C左右焙烧,再与一定浓度的硫酸反应制取硫酸铜的方法,对比分析本实验采用的硝酸氧化法制取CuSO4的优点是_______。
(6)用滴定法测定蓝色晶体中Cu2+的含量。取a g试样配成100 mL溶液,每次取20.00 mL用c mol·L-1EDTA(H2Y )标准溶液滴定至终点,平行滴定3次,平均消耗EDTA溶液b mL,滴定反应为Cu2++H2Y =CuY +2H+,蓝色晶体中Cu2+质量分数![]() _____%.
_____%.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用Ca与H2反应制取氢化钙(CaH2)。下列实验装置和原理不能达到实验目的的是( )
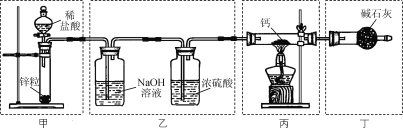
A. 装置甲制取H2B. 装置乙净化干燥H2
C. 装置丙制取CaH2D. 装置丁吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究X(仅含三种元素)的组成和热稳定性,设计并完成如下实验:
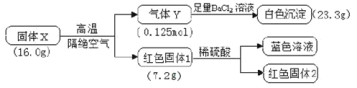
气体Y不能使品红溶液褪色,红色固体1是一种纯净物,请回答:
(1)X除了含有Cu元素之外,还有___元素(填元素符号)。
(2)该流程中X高温分解的化学方程式为____。
(3)写出气体Y通入BaCl2溶液发生反应的离子方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com