
| A、加成反应 |
| B、消去反应 |
| C、取代反应 |
| D、醇的催化氧化反应 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1mol CO2和CO的混合气中含有的氧原子数为1.5NA |
| B、常温常压下,11.2L氯化氢气体中含有的分子数为0.5NA |
| C、12g Mg与足量二氧化碳反应转移的电子数为NA |
| D、1mol?L-1 CuCl2溶液中含有的氯离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2H2O2
| ||||
B、2Al(OH)3
| ||||
| C、FeO+2HCl=FeCl2+H2O | ||||
| D、FeCl2+2NaOH=Fe(OH)2↓+2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH- |
| B、亚硫酸溶液呈酸性:H2SO3═2H++SO32- |
| C、氯化铝溶液跟过量的氨水反应:Al3++4OH-═[Al(OH)4]- |
| D、FeCl3溶液呈酸性:Fe3++3H2O?Fe(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、各物质的浓度不随时间变化 |
| B、容器的压强不再变化 |
| C、B的生成速率和D的生成速率为3:1 |
| D、混合气体的密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 它可通过不同化学反应分别制得B、C、D和E四种物质.
它可通过不同化学反应分别制得B、C、D和E四种物质.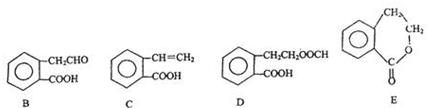
 、HCOOH、CH3COOC2H5
、HCOOH、CH3COOC2H5查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
| v(0min-10min) |
| v(10min-20min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com