
科目:高中化学 来源: 题型:阅读理解
| 84(m1-m2) |
| 31m1 |
| 84(m1-m2) |
| 31m1 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省六市高三第二次联考化学试卷(解析版) 题型:填空题
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位。工业制硝酸的主要反应之一是
(1)如果将4mol NH3和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为 。
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a正)、v(b逆)、v(c正)的大小关系是 。

(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:

①第2min到第4mim,反应速率v(O2)= ;
②第2min时改变了条件,改变的条件可能是 (从所给选项中选择);
A.降低温度 B.增加了生成物 C.减小压强 D.使用了高效催化剂
③在与第4min相同的温度下,若起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,则该反应 (填“正反应方向进行”、“逆反应方向进行”、“不移动”)。
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70—95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为 。
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:

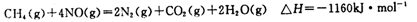
则1mol甲烷直接将NO2还原为N2的烩变为____ 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:
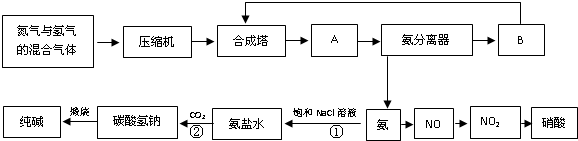
氨在国民经济中占有重要的地位。现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料。例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法。
(1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:

设备A的名称是 ,设备B的名称是 。
(2)硝酸厂的尾气中含有NO和NO2等污染物,为了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:
Na2CO3+2NO2=NaNO2+NaNO3+CO2
但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去。写出甲烷与NO2反应的化学反应方程式: 。
(3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染。可采用 法和 法进行改进。
(4)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?为什么 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08枣庄三诊)氨在国民经济中占有重要的地位。现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料。例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法。
|
(1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
设备A的名称是 ,设备B的名称是 。
(2)硝酸厂的尾气中含有NO和NO2等污染物,籽了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:Na2CO3+2NO2====NaNO2+NaNO3+CO2
但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去。写出甲烷与NO2反应的化学反应方程式: 。
(3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染。可采用 法和 法进行改进。
(4)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?为什么 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com