
【题目】硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)T℃时,2NO(g)+Cl2(g) ![]() 2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=____________;k=____________(注明单位)。
(3)在2L的恒容密闭容器中充入4mol NO(g)和2mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A
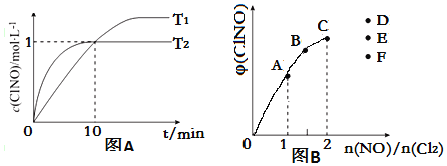
①温度为T1时,能作为该反应达到平衡的标志的有__________;
a 容器体积保持不变
b 容器压强保持不变
c 平衡常数K保持不变
d 气体颜色保持不变
e v(ClNO)= v(NO)
f NO与ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=____________;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随n(NO)/n(Cl2)的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是__________点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的__________点。
【答案】![]() /K1 2 4.0×10-7mol-1·L·s-1 bdf 0.05mol·L-1·min-1 2L/mol C F
/K1 2 4.0×10-7mol-1·L·s-1 bdf 0.05mol·L-1·min-1 2L/mol C F
【解析】
(1)已知①4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
将方程式2×②-①得方程式③,③为:2NO(g)+Cl2(g) ![]() 2ClNO(g),则平衡常数
2ClNO(g),则平衡常数![]() , 故答案为:
, 故答案为:![]() 。
。
(2)根据表中数据可知![]() 将n代入v正= k cn中,
将n代入v正= k cn中,![]() 。
。
(3)①a. 恒容条件下,容器体积始终保持不变,不能据此判断平衡状态,a错误;
b. 反应前后气体的物质的量减小,压强越小,当容器压强保持不变时,正逆反应速率相等,反应达到平衡状态,b正确;
c. 化学平衡常数只与温度有关,温度不变化学平衡常数不变,不能据此判断平衡状态,c错误;
d. 只有氯气有色,当气体颜色保持不变,正逆反应速率相等,反应达到平衡状态,d正确;
e. v(ClNO)=v(NO)时,反应方向未知,无法确定是否达到平衡状态,e错误;
f. NO与ClNO的物质的量比值保持不变时,正逆反应速率相等,反应达到平衡状态,f正确;故答案为:bdf。
②根据图像可知v(ClNO)=![]() ,同一时间段内各物质的反应速率之比等于其计量数之比,据此得v(Cl2)=1/2v(ClNO)=1/2×0.1mol/(L·min)=0.05mol/(L·min),故答案为:0.05mol·L1·min1。
,同一时间段内各物质的反应速率之比等于其计量数之比,据此得v(Cl2)=1/2v(ClNO)=1/2×0.1mol/(L·min)=0.05mol/(L·min),故答案为:0.05mol·L1·min1。
③开始c(NO)=4mol/2L=2mol/L、c(Cl2)=2mol/2L=1mol/L,根据三段式:

化学平衡常数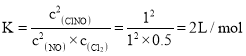 ,故答案为:2L/mol。
,故答案为:2L/mol。
(4)NO的物质的量越大其转化率越小,所以NO转化率最小的是C点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时,产物的含量减小,所以应该是F点,故答案为:C;F。


科目:高中化学 来源: 题型:
【题目】分别以下列各组物质作为单体在一定条件下,通过缩聚反应能合成高分子化合物的是( )
①乙烯、丙烯、苯乙烯
②乙酸、乙二醇
③1,![]() 己二酸、1,
己二酸、1,![]() 己二胺
己二胺
④对苯二甲酸、乙二醇
⑤α-氨基乙酸、α-氨基丙酸
⑥α-羟基丙酸
A.①③⑤⑥B.①②③④C.③④⑤⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅铬黄是一种颜料,主要成分是铬酸铅PbCrO4。现以CrCl36H2O 和 Pb(NO 3)2等为原料制备该物质,并测定产物纯度。
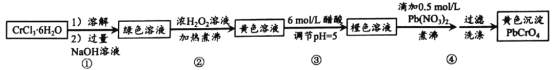
(1)溶解、过滤、洗涤操作时, 均需要用到的以下仪器为______________(填标号)。

(2)第①步所得绿色溶液的主要成分为 NaCrO2,已知 Cr(OH)3 不溶于水,与Al(OH)3类似,具有两性。写①步发生反应的离子方程式_____________________。
(3)第②步中加入H2O2 浓溶液的目的是___________________。溶液逐步变为亮黄色后,仍须持续煮沸溶液一段时间,目的是_____________________。
(4)第③步加入醋酸的目的是,防止pH 较高时,加入 Pb(NO3)2 溶液会产生______(填化学式)沉淀,影响产率。利用pH 试纸,调节 pH 的实验操作是_____________。pH逐步降低时, 溶液中的CrO42-转化为 ____________离子(填化学式)。
(5)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④ 步中逐滴滴加 Pb(NO3)2溶液后,产PbCrO4黄色沉淀, 此时为了提高铅铬黄的产率,可补加少量NaOH溶液,请用化学平衡移动原理加以解释:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol/L体积均为V0的HA、HB溶液分别加水稀释至体积为 V的溶液。稀释过程中,pH与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
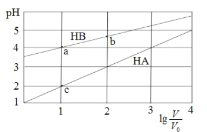
A.pH 随 ![]() 的变化始终满足直线关系
的变化始终满足直线关系
B.溶液中水的电离程度:a > b > c
C.该温度下,Ka(HB)≈ 10-6
D.分别向稀释前的HA、HB溶液中滴加 NaOH 溶液至 pH = 7 时,c(A-)= c(B-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,也可由咖啡酸合成,下列说法不正确的是( )

A. 1mol CPAE与足量的溴水反应,最多消耗4mol Br2
B. 咖啡酸可发生聚合反应,而且其分子中含有3种官能团
C. 与苯乙醇互为同分异构体的酚类物质共有9种
D. 可用金属Na检测上述反应是否残留苯乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X。一定条件下X可分别转化为Y、Z,如下所示。
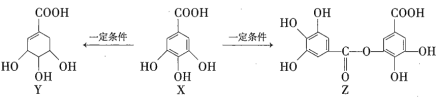
下列说法错误的是( )
A.![]() 最多能与
最多能与![]() 发生取代反应
发生取代反应
B.等物质的量的Z分别与Na和![]() 恰好反应时,消耗Na和
恰好反应时,消耗Na和![]() 的物质的量之比为6∶1
的物质的量之比为6∶1
C.一定条件下,Y能发生加成反应、取代反应、消去反应和氧化反应
D.![]() 最多能与
最多能与![]() 发生反应
发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤的烟气中常含有大量的NOx、CO、SO2等有害气体,治理污染、消除有害气体对环境的影响是化学工作者研究的重要课题。
Ⅰ.已知氮氧化物可采用强氧化剂Na2S2O8氧化脱除,过程如下所示:
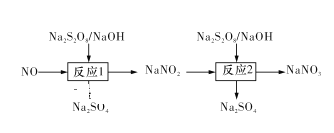
(1)写出反应1的离子方程式:____ 。
(2)反应2为NO2-+S2O82-+2OH-=NO3-+2SO42-+H2O。此反应在不同温度下达到平衡时,NO2-的脱除率与Na2S2O8初始浓度的关系如图1所示。
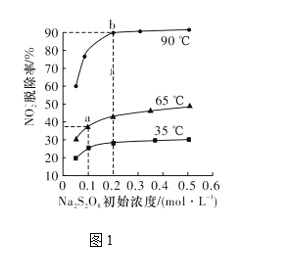
①比较a、b点的反应速率:va正____vb逆(填“>”“<”或“=”)。
②根据图像可以判断该反应为吸热反应,理由是____________。
Ⅱ.沥青混凝土可作为反应2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图2表示在相同的恒容密闭容器、相同的起始浓度、相同的反应时间段下,使用相同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图2表示在相同的恒容密闭容器、相同的起始浓度、相同的反应时间段下,使用相同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
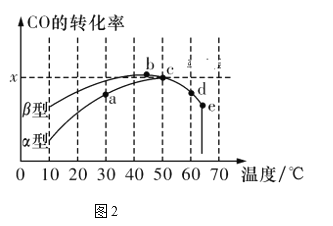
(3)下列关于图2的说法正确的是________。
A.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
B.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
C.a、b、c、d四点中,达到平衡状态的只有b、c两点
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
(4)已知c点时容器中O2浓度为0.02 mol/L,则50 ℃时,在α型沥青混凝土中CO转化反应的平衡常数K=_____________(用含x的代数式表示)。
Ⅲ.利用图3所示装置(电极均为惰性电极)可吸收SO2。
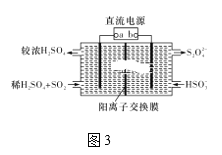
(5)直流电源b极为____,阳极发生的反应为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com