
某铁的氧化物样品,用5mol/L的盐酸140mL恰好完 全溶解,所得溶液还能吸收0.56L氯气(STP),使其中的Fe2+全部转化为Fe3+。则该氧化物的化学式为( )
全溶解,所得溶液还能吸收0.56L氯气(STP),使其中的Fe2+全部转化为Fe3+。则该氧化物的化学式为( )
A.Fe5O7 B.Fe2O3 C.Fe3O4 D. Fe4O5
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 全氟三丙胺由碳原子、氟原子和氮原子构成 | |
| B. | 全氟三丙胺的相对分子质量为449 | |
| C. | 一个全氟三丙胺分子中含有25个原子 | |
| D. | 全氟三丙胺由碳、氟、氮三种元素组成 |
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:推断题
A、B、C、D、E是中学常见的五种化合物,它们之间有下列转化关系:

已知A溶液显碱性,可促进水的电离;D溶液显酸性,A、D溶液焰色反应均为黄色。
(1)若A、B、C中含有相同的金属元素,且B能溶于酸也能溶于碱,D能与Ba(OH)2反应生成不溶于盐酸的白色沉淀。则A的化学式为 ,D的化学式为 ;A、C反应生成B的离子方程式为 。
(2)若C是一种无色无味的气体,且能使澄清石灰水变浑浊。用离子方程式表示A溶液显碱性的原因 ; C与E反应生成B的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2、KCl、CuSO4、NaNO3四种固体 | |
| B. | CCl4、乙醇、苯三种液体 | |
| C. | CaCO3、NaHSO4、Al2S3、Mg(OH)2四种固体 | |
| D. | NaCl、Na2SO4、AlCl3、MnO2四种固体 |
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
为了提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是( )
选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
A. | H2O(Br2) | CCl4 | 萃取分液 |
B. | MgCl2溶液(AlCl3) | 浓氨水 | 过滤 |
C. | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
D. | Si(Al) | NaOH溶液 | 过滤 |
查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:填空题
NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为____________(选填“酸性”、“碱性”或“中性”);原因是______________________。
(2)写出第二次氧化时发生反应的离子方程式_________________________。
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO__ _g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________、__________和H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
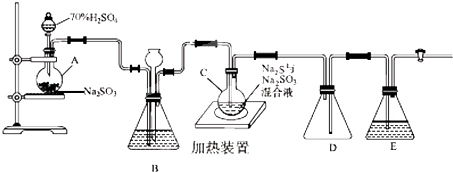
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com