
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 蓝 | Cl2+2I-=I2+2Cl- |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl |
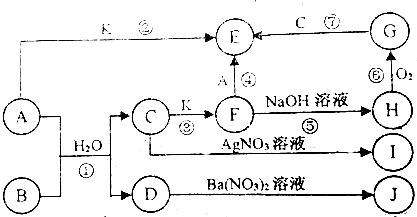
分析 通常状况下,A是一种黄绿色的非金属单质,则A为Cl2;B是一种有刺激性气味的气体,且有漂白性,A和B、水反应生成C和D,C和D是中学化学中常见的两种强酸,则B为SO2,A和K反应生成E,C和K反应生成F,F和氯气反应生成E,则K为变价金属,I和J不溶于水也不溶于稀硝酸,D能和硝酸钡反应,则C为HCl、D为H2SO4,K为Fe,E为FeCl3、F为FeCl2,I为AgCl、J为BaSO4,F和NaOH反应生成H,H能和氧气反应生成G,G和HCl反应生成氯化铁,则H为Fe(OH)2、G为Fe(OH)3,再结合题目分析解答.
解答 解:通常状况下,A是一种黄绿色的非金属单质,则A为Cl2;B是一种有刺激性气味的气体,且有漂白性,A和B、水反应生成C和D,C和D是中学化学中常见的两种强酸,则B为SO2,A和K反应生成E,C和K反应生成F,F和氯气反应生成E,则K为变价金属,I和J不溶于水也不溶于稀硝酸,D能和硝酸钡反应,则C为HCl、D为H2SO4,K为Fe,E为FeCl3、F为FeCl2,I为AgCl、J为BaSO4,F和NaOH反应生成H,H能和氧气反应生成G,G和HCl反应生成氯化铁,则H为Fe(OH)2、G为Fe(OH)3,
(1)物质B和I的化学式分别为SO2、AgCl,故答案为:SO2;AgCl;
(2)反应④为氯化亚铁和氯气的反应,该反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)反应⑥为氢氧化亚铁被氧气氧化的方程式,该反应的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)E是氯化铁,三价铁离子与硫氰根离子发生络合反应生成血红色硫氰合铁络合物,离子方程式为Fe3++3SCN-=Fe(SCN)3,取少量溶液于试管中,加入KSCN溶液,若出现血红色溶液证明原溶液中含Fe3+,
故答案为:取少量溶液于试管中,加入KSCN溶液,若出现血红色溶液证明原溶液中含Fe3+;
(5)整个反应过程中,每消耗0.1molKI,转移电子数3.612×1023个,即每消耗0.1molKI转移电子物质的量为0.6mol电子,则I元素化合价由-1价变为+5价,氯气具有强氧化性,能将碘离子氧化生成碘单质,碘遇淀粉试液变蓝色,所以看到的现象是溶液变蓝色,反应离子方程式为:Cl2+2I-=I2+2Cl-;
继续通入氯气,氯气能氧化碘单质生成碘酸,导致溶液褪色,所以看到的现象是溶液褪色,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:
| 验步骤 | 实验现象 | 用化学用语解释 |
| 蓝 | Cl2+2I-=I2+2Cl- | |
| 5Cl2+I2+6H2O=2HIO3+10HCl |
点评 本题考查无机物推断,为高频考点,涉及物质推断、离子方程式的书写、氧化还原反应、离子检验等知识点,明确元素化合物性质、化学反应原理是解本题关键,注意利用物质特殊性质进行推断,知道铁离子的检验方法及实验现象,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | CO2+H2O+2NaClO→Na2CO3+2HclO | |
| B. | HCN+Na2CO3→CO2+2NaCN+H2O | |
| C. | 结合质子能力由强到弱的顺序为:CO32->HCO3->CH3COO- | |
| D. | 常温下电离常数比较:Ki1(H2CO3)>Ki2(H2CO3)>Ki(C6H5OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时沸石的作用是防止液体受热时突然沸腾(爆沸) | |
| B. | 蒸馏操作时,需要将温度计水银球插入到蒸馏液体的液面以下 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应加热至蒸发皿中溶液全部蒸干 | |
| D. | 用浓硫酸配制稀硫酸时,可将量取好的浓硫酸直接转移至容量瓶后再加水定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的摩尔质量是44 g•mol-1,表示1 mol CO2的质量为44 g | |
| B. | 硫酸溶液的物质的量浓度为1 mol•L-1,表示1 L溶液中含有1 mol硫酸 | |
| C. | 气体摩尔体积Vm≈22.4 L•mol-1,表示1 mol任何气体的体积都约为22.4 L | |
| D. | 阿伏加德罗常数NA≈6.02×1023 mol-1,表示1 mol任何粒子集体所含的粒子数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | CH4 | C. | C2H2 | D. | C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH4 分子中含 10NA个电子 | B. | 22.4LCH4 分子中含 4NA 个共价键 | ||
| C. | 乙烯不能使溴水褪色 | D. | 苯属于烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NH4+、NO3-、Cl- | B. | Br-、Fe2+、Fe3+、SO42- | ||
| C. | Na+、SO32-、K+、NO3- | D. | K+、Na+、I -、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com