


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、(4)(3)(1)(2) |
| B、(3)(4)(2)(1) |
| C、(4)(2)(3)(1) |
| D、(4)(3)(2)(1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.
2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
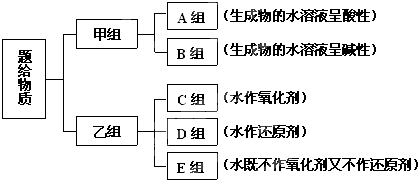
查看答案和解析>>
科目:高中化学 来源: 题型:
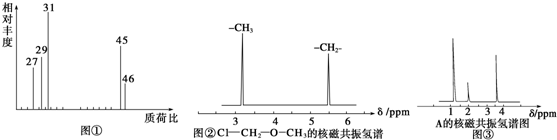
查看答案和解析>>
科目:高中化学 来源: 题型:
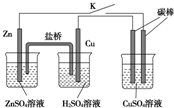 用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )| A、铜棒为正极,其电极反应式为:2H++2e-═H2↑ |
| B、烧杯右侧碳棒为阴极,其电极表面有红色物质析出 |
| C、反应中消耗锌的质量为13g |
| D、导线中通过电子的物质的量为0.2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com