
碱式碳酸铜(Cu2(OH)2CO3)是名贵的矿物宝石孔雀石的主要成分,应用广泛,如在无机工业中用于制造各种铜化合物,有机工业中用作有机合成催化剂等等,某化学小组为了探究碱式碳酸铜生成条件对其产率的影响,设计了如下实验:
设计原理:取一定体积的碳酸钠溶液(0.5mol/L)于100mL烧杯中,进行加热,恒温后将硫酸铜溶液(5.00mL. 0.5mol/L)在不断搅拌下以一定速度逐滴加入到上述碳酸钠溶液中,反应达平衡后,静止,减压过滤,洗涤,烘干,即得到最终产品,同时有气体放出。
(1)反应原理为:________________。
(2)探究反应原料用量比对反应产物的影响。
该化学小组根据所提供试剂设汁两个实验来说明反应原料用量对产品的影响
提供试剂:0.5mol/LNa2CO3溶液、0.5mol/LCuSO4溶液。
①请填写下表的空白处:
① | ② | ③ | ④ | |
硫酸铜溶液体积/mL | 2.0 | 2.0 | 2.0 | 2.0 |
碳酸钠溶液体积/mL | 1.6 | 2.0 | 2.8 | |
Na2CO3/CuSO4mol/比) | 0.8 | 1 | 1.4 |
②通过实验画图可知:当比值为______,碱式碳酸铜产量最好。
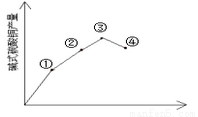
(3)反应温度对产率的影响
在三支试管中各加入2.0mL0.5 mol/LCuSO4溶液另取四支试管各加入由上述实验得到的合适用量的0.5 mol /L Na2CO3溶液。从这两列试管中各取一支将它们分別置于室温、30℃、50℃、100℃的环境中数分钟后将CuSO4溶液倒入Na2CO3溶液中振荡并观察现象,发现:沉淀颜色分别为蓝色沉淀,绿色沉淀、深绿色沉淀,绿色中带有黑色沉淀,实验结果也如上图所示,请思考,为什么温度过髙产率反而下降_______,该实验加热方式为____________。
(4)分析所制得的碱式碳酸铜的质量分数。
将已准确称量的0.5g试样样品放入300mL的锥形瓶中,加入5mL醋酸,适热使其溶解,再用l00mL水将其稀释。加入2.5gKI振荡混合,经过5分钟后,加入数滴淀粉溶液,用0.1mol/L的硫代硫酸钠溶液进行滴定。当_______时即达滴定的终点。
反应的原理:2Cu2++4I- =2CuI+I2,I2+2S2O32-=2I-+S4O62-
用0.lmol/L硫代硫酸钠40 mL,那么试样中铜的质量百分率为________。该溶液的滴定度为_______。(毎毫升标准溶液相当于被测物质的质量,单位是g/mL或mg/mL)(保留三位有效数字)。
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:选择题
根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:广西南宁市2017届高三第一次模拟测试理综化学试卷 题型:填空题
铜、硫的单质及其化合物在生产、生活中应用广泛,辉铜矿(主要成分是Cu2S)是冶炼铜和制硫酸的重要原料。
(1)已知:①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ/mol
②2Cu2O(s)+ Cu2S(s)=6Cu(s)+ SO2(g) △H=+116.0kJ/mol
则Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=__________。
(2)利用化石燃料开采、加工过程产生的H2S废气可制取氢气,既廉价又环保,若得到56L(标准状况)氢气,则转移的电子属为________。
(3)上述冶炼过程中会产生大量的SO2,回收处理SO2不仅能防止环境污染,而且能变害为宝。回收处理的方法之一是先将SO2转化为SO3,然后再转化为H2SO4。
①450℃时,某恒容密闭容器中存在反应:2SO2(g)+O2(g) 2SO2(g)△H<0,下列事实能表明该反应达到平衡的是___________。
2SO2(g)△H<0,下列事实能表明该反应达到平衡的是___________。
A.容器内气体密度不变 B.O2、SO2的消耗速率之比为1:2
C.n(SO2):n(O2):n(SO3)=2:1:2 D.容器内压强不再发生交化
②450℃、0.1Mpa下,将2.0molSO2和1.0molO2置于5L密闭容器中开始反应,保持温度和容器体积不变,SO2的转化率(a)随着时间(t)的变化如图1所示。则该温度下反应的平衡常数K=_____。若维持其他条件不变,使反应开始时温度升高到500℃ ,请在图l中画出反应从开始到平衡时SO2转化率的变化图像_______。
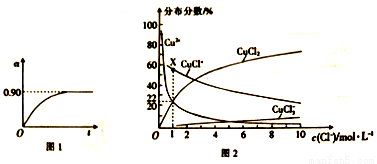
(4)已知CuCl2溶液中,铜元素的存在形式与c(Cl-)的相对大小有关,具体情况如图2所示(分布分数是指平衡体系中各含铜微粒物质的量占铜元素总物质的量的百分比)。
①若溶液中含铜微粒的总浓度为amol/L,则X点对应的c(CuCl+)=___________ (用含a的代数式表示)。
②向c(Cl-)=1mol/L的氯化铜溶液中滴人少量AgNO3溶液,则浓度最大的含铜微粒发生反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师范大学附属中学高一3月月考化学试卷(解析版) 题型:选择题
已知钡的金属活动性介于钠和钾之间,下列叙述中正确的是( )
A. 钡与水反应不如钠与水反应剧烈 B. 钡可以从NaCl溶液中置换出钠
C. 氧化性:K+>Ba2+>Na+ D. 碱性:KOH>Ba(OH)2>NaOH
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师范大学附属中学高一3月月考化学试卷(解析版) 题型:选择题
短周期元素X、Y组成的化合物X2Y,那么X、Y所在主族序数可能是( )
A. ⅡA和ⅦA B. ⅤA和ⅥA C. ⅥA和ⅥA D. ⅠA和ⅥA
查看答案和解析>>
科目:高中化学 来源:2017届河北省石家庄市高三下学期模拟联考理科综合化学试卷(解析版) 题型:选择题
核磁共振氢谱中根据分子中不同化学环境的氢原子在谱图中给出的信号峰不同来确定分子中氢原子种类的。在下列5种有机分子中,核磁共振氢谱中给出的信号峰数目相同的一组是( )

A. ①② B. ②④ C. ④⑤ D. ③⑤
查看答案和解析>>
科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:实验题
甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在下图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50mL和5 mol·L-1NaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
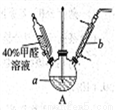
①仪器b的名称是___________,作用为__________。
②能说明甲醛具有还原性的实验现象是___________。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含H2不含CO,将装置A和如下图所示的装置连接后进行实验。
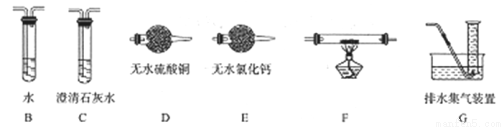
依次连接的合理顺序为A→B→___→___→___→___G,装置B的作用是_________。
(3)已知: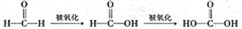 。设计实验证明a中甲醛的碳元素未被氧化成+4价。_________________。
。设计实验证明a中甲醛的碳元素未被氧化成+4价。_________________。
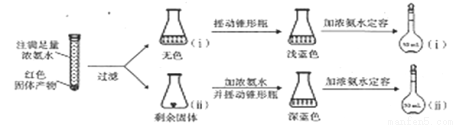
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应);
已知:Cu2O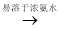 [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) [Cu(NH3)4]2+](蓝色)。
[Cu(NH3)4]2+](蓝色)。
①摇动锥形瓶ⅰ的目的是_____________。
②锥形瓶ⅱ中固体完全溶解得深蓝色溶液的离子方程式为______________。
③将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近。由此可知固体产物的组成及物质的量之比约为_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.CS2是极性键构成的极性分子
B.SO2与CO2为等电子体
C.金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高
D.1molNaHSO4熔融态时有3mol离子
查看答案和解析>>
科目:高中化学 来源:2017届陕西省咸阳市高三二模理综化学试卷(解析版) 题型:填空题
(1)普鲁士蓝的化学式为Fe4[Fe(CN)6]3,该物质中存在的化学键有离子键、
_____和_____;含有的Fe3+的核外电子排布式为______。
(2)KCN可被H2O2氧化为KOCN
①KOCN可作为制药原料,其晶体类型是____;碳原子采取sp杂化,1mol该物质中含有的π键数目为______。含有的三种非金属元素的电负性由大到小的顺序是______。
②H2O2常温下是液体,沸点较高(150℃),其主要原因是______。
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下左图,As原子的杂化方式为___,雌黄和SnCl2在盐酸中反应转化为雌黄(As4S4)和SnCl4,SnCl4分子的空间构型为______。

(4)某晶体的晶胞结构如上右图所示,该晶体的化学式为_____,该晶胞参数为a=250.4pm,c=666.1pm,y=120o;1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0),则3号原子坐标为_____,计算上述晶体中A和B两原子间的最小核间距为____。(保留四位有效数字。已知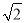 =1.141,
=1.141, 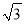 =1.732.)
=1.732.)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com