
| V |
| Vm |
| 1.95g |
| 78g/mol |
| 5.6L |
| 22.4L/mol |


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
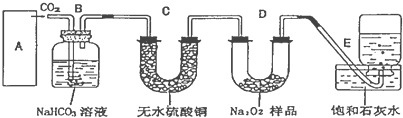
 工业上以黄铁矿为原料,采用接触法生产硫酸.请回答下列问题:
工业上以黄铁矿为原料,采用接触法生产硫酸.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先生成CuS 沉淀,后生成FeS 沉淀 |
| B、先生成FeS 沉淀,后生成CuS 沉淀 |
| C、先生成CuS 沉淀,不生成FeS 沉淀 |
| D、先生成CuS 沉淀,反应一段时间FeS和CuS同时沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
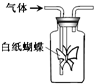 如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )
如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )| A | B | C | D | |
| 喷洒液 | 酚酞 | 黄色甲基橙 | 紫色石蕊 | 酸化的KI-淀粉 |
| 通入的气体 | NH3 | Cl2 | SO2 | O2 |
| 预测的颜色变化 | 变为红色 | 先橙后褪色 | 先红后褪色 | 变为蓝色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
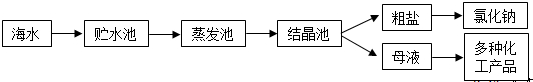
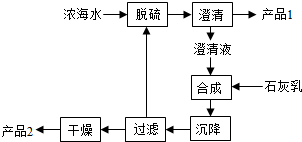
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AB2 |
| B、A2B4 |
| C、AB |
| D、A2B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com