
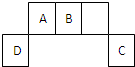
 短周期元素A、B、C、D在周期表中位置如图所示,其中元素D原子最外层有3个电子.
短周期元素A、B、C、D在周期表中位置如图所示,其中元素D原子最外层有3个电子.| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液中滴入NaOH溶液 |
| B、向NaOH溶液中通入SO2气体 |
| C、向浓硫酸中加入过量铜片共热 |
| D、向Na2CO3溶液中滴入盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 |
| B、Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 |
| C、相同条件下,2mol氢原子所具有的能量大于1mol氢分子所具有的能量 |
| D、煤经气化和液化两个物理变化过程,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
| 弱电解质 | HF | BaSO4 | HClO | CH3COOH |
| 非电解质 | Cl2 | CO2 | C2H5OH | H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应,X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应,X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )| A、反应速率:v(B)>v(A) |
| B、A容器中X的转化率为80% |
| C、平衡时Y体积分数:A<B |
| D、打开活塞K重新达平衡VA=2.2aL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2能漂白某些物质,说明它具有氧化性 |
| B、SO2的水溶液能使紫色石蕊溶液变红,说明它能与水反应生成亚硫酸 |
| C、将足量的SO2通入酸性高锰酸钾溶液中,溶液褪色,说明它具有还原性 |
| D、实验室可以用氢氧化钠溶液处理含有SO2的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com