
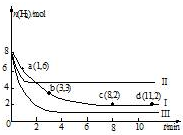
 一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:
一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:| A. | 该反应在0~8min内CO2的平均反应速率是0.375mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3molCO2和4molH2,则平衡时H2的条件分数大于20% | |
| C. | 若起始是向上述容器中充入4molCO2、2molH2、2molCH3OH和1molH2O(g),则此是反应向正反应方向进行 | |
| D. | 改变条件得到曲线II、III,则曲线II、III改变的他分别是升高温度、充入氢气 |
分析 A.根据v=$\frac{△c}{△t}$计算v(H2),再利用速率之比等于其化学计量数之比计算v(CO2);
B.由图可知,I平衡时氢气为2mol,利用三段式计算平衡时各组分物质的量,进而计算氢气体积分数.若起始时向上述容器中充入3 mol CO2和4 mol H2,等效为原平衡压强减小一倍,平衡向逆反应方向移动,氢气的体积分数增大;
C.根据B中计算可知平衡时二氧化碳、氢气、甲醇、水的浓度,代入平衡常数表达式K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$计算平衡常数,再计算此时的浓度商Qc,与平衡常数比较,判断反应进行方向;
D.与Ⅰ相比,Ⅱ到达平衡时间短,且平衡时氢气浓度大,说明改变条件反应速率加快、反应向逆反应方向移动;与I相比,Ⅲ到达平衡时间短,且平衡时氢气浓度小,说明改变条件反应速率加快、反应向正反应方向移动.
解答 解:A.由图可知,0~8 min内H2的物质的量变化量为8mol-2mol=6mol,故v(H2)=$\frac{\frac{6mol}{2L}}{8min}$=0.375 mol•L-1•min-1,速率之比等于其化学计量数之比,故v(CO2)=$\frac{1}{3}$v(H2)=0.125 mol•L-1•min-1,故A错误;
B.由图可知,I平衡时氢气为2mol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol):6 8 0 0
转化(mol):2 6 2 2
平衡(mol):4 2 2 2
故I中平衡时氢气体积分数为$\frac{2mol}{4mol+2mol+2mol+2mol}$=20%,若起始时向上述容器中充入3 mol CO2和4 mol H2,等效为原平衡压强减小一倍,平衡向逆反应方向移动,氢气的体积分数增大,即平衡时H2的体积分数大于20%,故B正确;
C.平衡常数K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$=$\frac{1×1}{2×{1}^{3}}$=0.5,此时的浓度商Qc=$\frac{\frac{2}{2}×\frac{1}{2}}{\frac{4}{2}×(\frac{2}{2})^{3}}$=0.25<K=0.5,故平衡向正反应方向移动,故C正确;
D.与Ⅰ相比,Ⅱ到达平衡时间短,且平衡时氢气浓度大,说明改变条件反应速率加快、反应向逆反应方向移动,若升高温度,反应速率加快,正反应为放热反应,平衡向逆反应方向移动,符合题意;与I相比,Ⅲ到达平衡时间短,且平衡时氢气浓度小,说明改变条件反应速率加快、反应向正反应方向移动,若充入氢气,氢气的物质的量应减少,而图中变大,不符合题意,故D错误;
故选BC.
点评 本题考查物质的量随时间变化曲线、反应速率影响因素及计算、化学平衡影响因素与计算、平衡常数应用等,侧重考查学生分析计算能力,C中注意利用平衡常数判断反应进行方向,难度中等.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
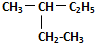 和
和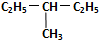 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的系统命名:2-丙醇 的系统命名:2-丙醇 | B. | 明矾的化学式:KAl(SO4)2•12H2O | ||
| C. | CH4Si的结构式: | D. | H2O2的球棍模型: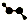 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 运液氯可用钢瓶装,车上应贴 标志.装运浓硫酸可用铝槽罐车,应贴 标志.装运浓硫酸可用铝槽罐车,应贴 标志 标志 | |
| B. | 冬天严禁在窗门紧闭的室内用煤饼炉取暖,因为生成的CO、SO2等容易引起中毒 | |
| C. | 用铝锅煮菜一般在起锅之前才放盐,既减少加碘盐的损耗,又能增加铝锅的使用寿命 | |
| D. | 严禁在写作业时将铅笔放入口中啃咬,否则会引起铅中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
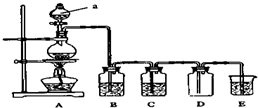 如图是实验室中制备气体或验证气体性质的装置图.
如图是实验室中制备气体或验证气体性质的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
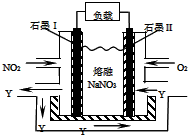 (1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究.
(1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com