

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ��ѧ�� | P��P | P��O | O��O | P��O |
| ����/ kJ��mol�C1 | 198 | 360 | 498 | X |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

A����̿�ڸ�������ˮ�����ķ�Ӧ�����ȷ�Ӧ | B�����ȷ�Ӧһ���Ƿ�Ӧ������������������������ | C�������Ǿ���һ����Դ�ӹ�ת���õ�����Դ����ˣ����ڶ�����Դ | D���Ͽ��ɵĻ�ѧ���ų����������γ��»�ѧ�����յ�����֮��ͨ������������ʽ�ͷ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��2Fe(s)��O2(g ) = Fe2O3(s) �ġ�H��
��2Fe(s)��O2(g ) = Fe2O3(s) �ġ�H��| A����824.4kJ��mol��1 | B����627.6kJ��mol��1 |
| C����744.7kJ��mol��1 | D����169.4kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���˷�ӦΪ���ȷ�Ӧ |
| B������ʯī�Ļ�ѧ����Ҫ���յ�����С���γɽ��ʯ�Ļ�ѧ���ų������� |
| C��ʯī�Ƚ��ʯ�ȶ� |
| D���˷�ӦΪ�����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CH4(g)+2O2(g)=CO2(g)+2H2O(g)����H��-801.3KJ/mol ���ۣ�CH4��ȼ����Ϊ801.3KJ |
B��Sn(s����) Sn(s����)����H��+2.1KJ/mol������Ϊ��ĩ״�� Sn(s����)����H��+2.1KJ/mol������Ϊ��ĩ״�����ۣ�����Ʒ�ں���Ķ�������ת��Ϊ�������� |
| C��ϡ��Һ���У�H+(aq)+OH��(aq)=H2O(l)����H��-57.3KJ/mol ���ۣ��������백ˮ��ϡ��Һ��Ϻ�������1molH2O�����ų�57.3KJ������ |
| D��C(s��ʯī)+O2(g)=CO2(g)����H=��393.5kJ��mol��1�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��2SO2+O2 2SO3�� ��H=-196.6kJ/mol 2SO3�� ��H=-196.6kJ/mol |
| B��C(s)+O2(g)==CO2(g)����H=393.5kJ/mol |
| C��1/2H2(g)+1/2Cl2(g)==HCl(g)����H=-92.5kJ/mol |
| D��H+(aq)+OH-(aq)==H2O(l)����H=57.3kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
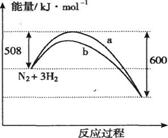
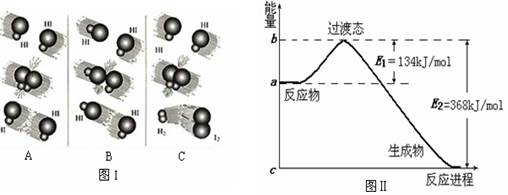
A���÷�Ӧ���Ȼ�ѧ����ʽΪ��N2+3H2 2NH3��H=��92kJ��mol��1 2NH3��H=��92kJ��mol��1 |
| B��a�����Ǽ������ʱ�������仯���� |
| C������������û�ѧ��Ӧ�ķ�Ӧ�Ȳ��� |
| D������ͬ�¶ȵ������£��������ͬI��II���������зֱ�ͨ��1mol N2��3 mol H2������I����㶨������II����ɱ䱣�ֺ�ѹ����Ӧ�������������ڵķ�Ӧ����V(I)<V(II) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Ũ�����ϡ�� | B�����ȷ�Ӧ |
| C��������ԭ����ͭ | D��Ba(OH)2��2H2O��NH4Cl�����壩��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com