

| A. | 青蒿素的化学式为C15H20O5 | |
| B. | 青蒿素转化为双氢青蒿素是氧化反应 | |
| C. | 青蒿素、双氢青蒿素分子内各含有2个七元环 | |
| D. | 青蒿素、双氢青蒿素分子内均含有7个手性碳原子 |
分析 A.根据结构简式确定分子式;
B.青蒿素转化为双氢青蒿素时和氢气发生加成反应,也是还原反应;
C.青蒿素、双氢青蒿素分子内各含有2个七元环,3个六元环;
D.青蒿素手性碳原子如 ,所以有7个;双氢青蒿素分子内含有8个手性碳原子.
,所以有7个;双氢青蒿素分子内含有8个手性碳原子.
解答 解:A.青蒿素的化学式为C15H22O5,故A错误;
B.青蒿素转化为双氢青蒿素时和氢气发生加成反应,也是还原反应,故B错误;
C.青蒿素、双氢青蒿素分子内各含有2个七元环,3个六元环,故C正确;
D.青蒿素手性碳原子如 ,所以有7个;双氢青蒿素分子内含有8个手性碳原子,比青蒿素中多连接羟基的碳原子,故D错误;
,所以有7个;双氢青蒿素分子内含有8个手性碳原子,比青蒿素中多连接羟基的碳原子,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,难点是判断手性碳原子个数,题目难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
 下列有关实验的操作、现象和原理,正确的是( )
下列有关实验的操作、现象和原理,正确的是( )| A. | ②④⑤ | B. | ③⑤⑥ | C. | ③⑤⑥⑦ | D. | ②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,E元素的电子排布式为1s22s22p63s23p63d5s4s1.
,E元素的电子排布式为1s22s22p63s23p63d5s4s1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、CH3COO-、NH4+ | B. | Mg2+、Ba2+、Br- | ||
| C. | Cu2+、Cl-、I- | D. | K+、Cl-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的NaCl溶液是指此溶液中含有1 mol NaCl | |
| B. | 从1L 0.5mo1/L的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.1mol/L | |
| C. | 0℃时,1molC12的体积约为22.4L | |
| D. | 1mol/L的CaCl2溶液中,Cl-的物质的量浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
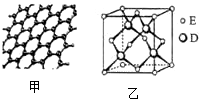 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com