
【题目】已知:还原性HSO3->I-,氧化性IO3->I2。在含3mol NaHSO3的溶液中逐滴加人KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是

A. 0-a段发生反应:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b段共消耗NaHSO3的物质的量为1.8mol
C. b~c段反应:氧化产物为I2
D. 当溶液中I-与I2的物质的量之比为5 : 1时,加入的KIO3为1.lmol
【答案】D
【解析】还原性HSO-3>I-,所以首先发生:IO3-+3HSO3-=I-+3SO42-+3H+,继续加入NaIO3,由于氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-=3H2O+3I2。A、根据以上分析可知0~a段发生反应:3HSO3-+ IO3-=3SO42-+I-+3H+,A正确;B、a点碘酸钠的物质的量是0.4mol,根据碘酸钠和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的量=![]() ×3=1.2mol,则a点时剩余NaHSO3的物质的量为1.8 mol,因此a~b段共消耗NaHSO3的物质的量为1.8mol,B正确;C、根据以上分析可知b~c段反应:IO3-+6H++5I-=3H2O+3I2,氧化产物为I2,C正确;D、根据反应IO3-+3HSO3-=I-+3SO42-+3H+,3mol NaHSO3的溶液消耗NaIO3溶液的物质的量为1mol,生成碘离子的量为1mol,设生成的碘单质的物质的量为n,则根据反应IO3-+6H++5I-=3H2O+3I2,消耗的NaIO3的物质的量为
×3=1.2mol,则a点时剩余NaHSO3的物质的量为1.8 mol,因此a~b段共消耗NaHSO3的物质的量为1.8mol,B正确;C、根据以上分析可知b~c段反应:IO3-+6H++5I-=3H2O+3I2,氧化产物为I2,C正确;D、根据反应IO3-+3HSO3-=I-+3SO42-+3H+,3mol NaHSO3的溶液消耗NaIO3溶液的物质的量为1mol,生成碘离子的量为1mol,设生成的碘单质的物质的量为n,则根据反应IO3-+6H++5I-=3H2O+3I2,消耗的NaIO3的物质的量为![]() mol,消耗碘离子的量为
mol,消耗碘离子的量为![]() mol,剩余的碘离子为(1-
mol,剩余的碘离子为(1-![]() )mol,当溶液中n(I-):n(I2)=5:1时,即(1-
)mol,当溶液中n(I-):n(I2)=5:1时,即(1-![]() )mol:nmol=5:1,故n=0.15mol,故加入的n(NaIO3)=1mol+
)mol:nmol=5:1,故n=0.15mol,故加入的n(NaIO3)=1mol+![]() mol=1mol+0.05mol=1.05mol,D错误,答案选D。
mol=1mol+0.05mol=1.05mol,D错误,答案选D。


科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
II | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2<T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生如下反应:PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 | 平衡物质的量 | 达到平衡所需时间 | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl50.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.
光解水的催化材料可用硝酸镍、硫脲和锐钛矿为原料,采用醇热法制得。
(1)Ni2+基态核外电子排布式为__________________。
(2)与NO3-互为等电子体的一种分子的化学式为__________________。
(3)硫脲(![]() )中C原子轨道的杂化类型为__________________;
)中C原子轨道的杂化类型为__________________;
1 mol硫脲中含有键的数目为____________mol。
钛的一种氟化物晶胞结构如右图所示,其化学式为____________。

(5)甘油(丙三醇)具有保持水分的功效,其主要原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g) ![]() CO(NH2)2 (l)+H2O (l)。
CO(NH2)2 (l)+H2O (l)。
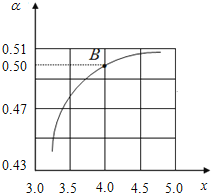
(1)T1℃时,在2L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是__________________.
=x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是__________________.
(2)当x=2,上述反应至5min时各物质的浓度不再发生变化,若起始的压强为P0KPa,测得平衡体系压强变为起始时的![]() 。反应结束后,分离得到90g尿素。
。反应结束后,分离得到90g尿素。
试计算该反应的平均速率υ(CO2)=________________,该反应的平衡常数K=___________,达到平衡后NH3的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取下列气体,所用药品正确的是 ( )
A. 用碳酸钙与稀硫酸反应制取CO2
B. 用H2O2溶液和MnO2制取O2
C. 用铁与浓硫酸反应制取氢气
D. 用氯化铵加热分解制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍 ![]() Th的原子可发生下列放射性变化:
Th的原子可发生下列放射性变化: ![]() Th→
Th→ ![]() X+
X+ ![]() He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是( )
He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是( )
A.X的氢氧化物是一种强碱
B.X元素位于第六周期
C.X的碳酸盐难溶于水
D.X的最高化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是课外活动小组设计的用化学电源使LED灯发光的装置,下列说法错误的是( ) 
A.如果将硫酸换成橙汁,导线中不会有电子流动
B.氢离子在铜片表面被还原
C.锌是负极,电子从锌片经导线流向铜片
D.装置中存在化学能→电能→光能”的转换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com