
【题目】下列有关Na2CO3和NaHCO3的性质比较中,正确的是
A. 热稳定性:Na2CO3 < NaHCO3
B. 常温时水溶性:Na2CO3 > NaHCO3
C. 与稀盐酸反应速率:Na2CO3 < NaHCO3
D. 相对分子质量:Na2CO3 < NaHCO3
【答案】BC
【解析】A、NaHCO3不稳定,加热易分解:2NaHCO3![]() Na2CO3+CO2↑+H2O,选项A错误;B、常温下,相同溶剂时,碳酸钠的溶解度大,即相同温度下,在水中Na2CO3的溶解度大于NaHCO3,选项B正确;C、都与盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,等物质的量的Na2CO3和NaHCO3分别与盐酸反应,放出CO2的速率NaHCO3的快,选项C正确;D、Na2CO3 和 NaHCO3的相对分子质量分别为106、84,故相对分子质量:Na2CO3>NaHCO3,选项D错误。答案选BC。
Na2CO3+CO2↑+H2O,选项A错误;B、常温下,相同溶剂时,碳酸钠的溶解度大,即相同温度下,在水中Na2CO3的溶解度大于NaHCO3,选项B正确;C、都与盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,等物质的量的Na2CO3和NaHCO3分别与盐酸反应,放出CO2的速率NaHCO3的快,选项C正确;D、Na2CO3 和 NaHCO3的相对分子质量分别为106、84,故相对分子质量:Na2CO3>NaHCO3,选项D错误。答案选BC。


科目:高中化学 来源: 题型:
【题目】充分利用黄铁矿(主要成份为FeS2)对资源和环境具有重要的意义。
(1)一种酸性条件下催化氧化黄铁矿的物质转化关系如下面图Ⅰ所示。
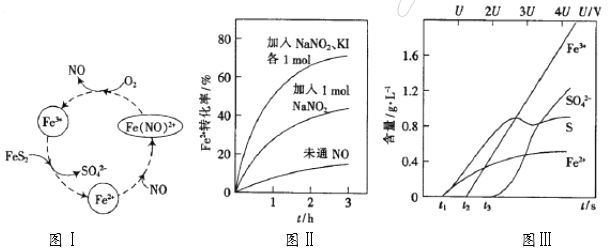
①图Ⅰ中,NO起的是_____作用;O2氧化FeS2生成Fe3+的离子方程式为____________;
②硝酸也可以将FeS2氧化为Fe3+和SO42-,但使用稀硝酸比浓硝酸的反应速率快很多,其原因是:_________。
(2)控制Fe3+的浓度、溶液体积和通入O2的速率一定,图Ⅱ表示当改变其它条件时Fe2+被氧化的转化率随时间的变化。
①加入NaNO2发生反应:3NO2-+2H+==NO3-+2NO↑+H2O。若3molNaNO2完全反应,则转移的电子数为____________________mol。
②在酸性溶液中,加入NaNO2、KI发生反应生成NO和I2,该离子反应方程式为______ ;图Ⅱ中曲线从下至上, Fe2+转化速率依次增大的原因是________。
(3)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生的粒子的含量与时间(t)、电压(U)之间的关系如图Ⅲ所示。
①t1至t2间FeS2发生的电极反应式为_________________。
②当电压值介于3.5U~4.4U之间时,FeS2放电所得的主要粒子为_______________。
③黄铁矿含有杂质钴和镍。若电解一段时间,c(Fe3+)=1×10-2mol·L-1时,通过计算判断:pH控制为_______不会产生Fe(OH)3沉淀;当使Co2+沉淀完全时,Fe3+_____(填:“已经”或“没有”)开始沉淀。{已知:离子浓度≤1×10–5mol·L–1认为沉淀完全;Ksp[Fe(OH)3]=3.8×10–38、Ksp[Co(OH)2]=2×10–15, ![]() = – 0.16}
= – 0.16}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是( )
A.制催化剂的材料B.耐高温、耐腐蚀的合金材料
C.半导体材料D.制农药的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列食品添加剂与类别对应正确的一组是
A. 着色剂_______苯甲酸钠
B. 调味剂_______亚硝酸钠
C. 营养强化剂_______粮食制品中加赖氨酸
D. 防腐剂_______苋菜红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.与煤、石油相比较,天然气是一种比较清洁的化石燃料
B.乙醇是一种可再生能源,作为燃料的优点是完全燃烧的产物不污染环境
C.利用太阳能、风能和氢能等能源替代化石能源能有效改善空气质量
D.煤转化为水煤气再燃烧放出的热量不会增加,因此煤的气化毫无意义
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.纤维素水解的最终产物为葡萄糖B.油脂的皂化反应属于加成反应
C.聚乙烯能使溴的四氯化碳溶液褪色D.蛋白质遇金属离子会变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列各量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体的总物质的量⑤混合气体的平均相对分子质量⑥v(C)与v(D)的比值⑦混合气体的总质量⑧混合气体的总体积⑨C、D的分子数之比为1∶1
A.①②③④⑤⑥⑦⑧ B.①③④⑤⑧⑨ C.①②③④⑤⑦ D.①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com