
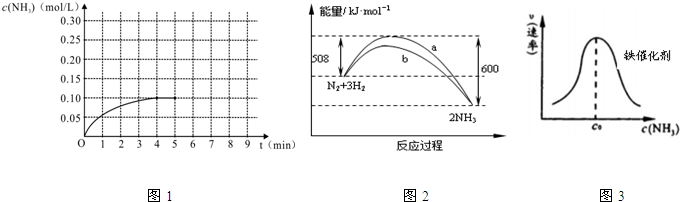
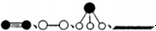
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分析 (1)①根据v(H2)=$\frac{3}{2}$c(NH3)进行计算;
②根据反应的可逆性特点以及温度改变平衡一定发生移动进行判断;
(2)A.加入催化剂能降低反应所需活化能;
B.在密闭容器中加入1mol N2、3mol H2,该反应是可逆反应,反应物不能完全转化;
C.由图可知,该反应是放热反应,即断键吸收的能量小于成键放出的能量;
D.反应物的总能量高于生成物的能量;
(3)①化学键的断裂要吸收能量,且该反应放热;
②c0前氨的浓度增加,导致反应速率加快;c0后由于氨分子浓度太大阻碍N2和H2的解吸;
(4)阴极上氨气或铵根离子得电子发生还原反应.
解答 解:(1)①根据图象分析平衡时氨气的浓度为0.1mol/L,时间为4min,所以依据速率之比等于系数之比得到:v(H2)=$\frac{3}{2}$v(NH3)=$\frac{3}{2}$×$\frac{0.1mol/L}{4min}$=0.0375 mol/(L•min),故答案为:0.0375;
②该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,故答案为:AC;
(2)A.加入催化剂能降低反应所需活化能,b所需活化能较小,所以b是加入催化剂的反应,故A正确;
B.在密闭容器中加入1mol N2、3mol H2,该反应是可逆反应,反应物不能完全转化,则充分反应放出的热量小于92kJ,故B正确;
C.由图可知,该反应是放热反应,断开1mol 氮氮三键与3mol 氢氢键吸收的能量和小于形成3mol 氮氢键所放出的能量,故C错误;
D.该反应是放热反应,反应物的总能量高于生成物的能量,故D错误;
故选AB;
(3)①由于化学键的断裂要吸收能量,故活化状态B的能量高于初始状态A的能量,而此反应为放热反应,故初始状态A的能量高于末态C的能量,故C的能量最低,故答案为:C;
②c0前氨的浓度增加,导致反应速率加快;c0后由于氨分子浓度太大阻碍N2和H2的解吸,故反应速率减慢,故答案为:氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大;达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸;
(4)阴极上氨气或铵根离子得电子发生还原反应,电极反应式为2NH3+2e-=H2+2NH2- 或2NH4++2e-=H2↑+2NH3,
故答案为:2NH3+2e-=H2+2NH2- 或2NH4++2e-=H2↑+2NH3.
点评 本题考查化学平衡计算、化学平衡影响因素、电解原理等知识点,为高频考点,明确化学反应原理及电解原理是解本题关键,侧重考查学生分析计算能力,难点是电极反应式的书写,题目难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
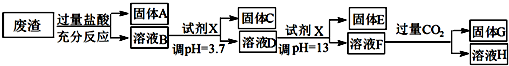
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆原理相似 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO${\;}_{3}^{2-}$+2HClO | |
| D. | 等体积、等物质的量浓度AlCl3与NaOH溶液混合:Al3++4OH-═AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某品牌化妆品声称“我们拒绝化学,本品不含任何化学物质” | |
| B. | 用漂粉精和洁厕灵的混合液清洗马桶效果更佳 | |
| C. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| D. | 新核素的发现意味着新元素的合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL1mol/L的Na3PO4溶液中含有离子数多于0.4NA | |
| B. | 1molAlCl3跟水反应完全转化成氢氧化铝胶体后,生成胶体粒子的数目为1NA | |
| C. | 12g石墨晶体中含有碳碳键数目为2×6.02×1023 | |
| D. | 标准状况下,22.4LCHCl3中含有氯原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com