
| A. | baXn-中含有的中子数为a+b | B. | baXn-中含有的电子数为a-n | ||
| C. | X原子的质量约为(b/NA)g | D. | 此元素的相对原子质量为b |
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  从碘水中分离出碘 | B. |  检验试液中NH${\;}_{4}^{+}$的存在 | ||
| C. |  干燥SO2气体 | D. |  收集HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
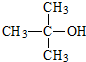
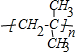
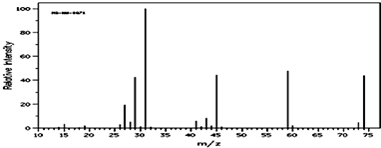
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 的加成类似于
的加成类似于 的加成)
的加成) .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
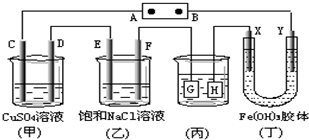
| A. | 电源B极是正极 | |
| B. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 | |
| D. | 装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
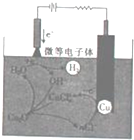 氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂灯领域有着广泛的用途.回答下列问题:
氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂灯领域有着广泛的用途.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com