
【题目】下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子: ![]() Cl
Cl
B.氯离子(Cl﹣)的结构示意图: 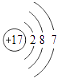
C.氯分子的电子式: ![]()
D.氯化氢的结构式:H﹣Cl
【答案】CD
【解析】解:A.质子数为17、中子数为20的氯原子质量数为37,该原子正确的表示方法为:1737Cl,故A错误;
B. 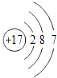 为氯原子结构示意图,氯离子的最外层达到8电子稳定结构,氯离子正确的离子结构示意图为:
为氯原子结构示意图,氯离子的最外层达到8电子稳定结构,氯离子正确的离子结构示意图为: 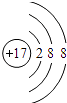 ,故B错误;
,故B错误;
C.氯分子中含有1个Cl﹣Cl键,其电子式为 ![]() ,故C正确;
,故C正确;
D.HCl为共价化合物,分子中含有H﹣Cl键,其结构式为:H﹣Cl,故D正确;
故选CD.
A.质量数=质子数+中子数,元素符号的左上角为质量数;
B.氯离子的核外电子总数为18,最外层满足8电子稳定结构;
C.氯气分子中含有1个Cl﹣Cl键,最外层满足8电子稳定结构;
D.用短线代替所有的共用电子对即为结构式,氯化氢分子中含有1个H﹣Cl键.


科目:高中化学 来源: 题型:
【题目】【2016宜春校级三模】对于反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
A.v(NH3)=0.2molL﹣1s﹣1 B.v(O2 )=0.24 molL﹣1s﹣1
C.v(H2O)=0.25 molL﹣1s﹣1 D.v(NO)=0.15 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017金凤区校级三模】一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g).图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.
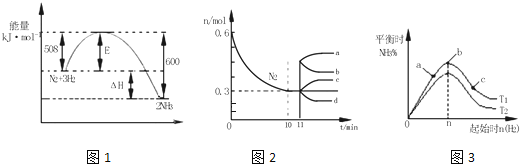
①由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 ;
②图3a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
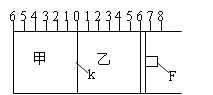
(1)可根据 _______________现象来判断甲乙都已达到平衡状态。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是___________________。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,反应化学平衡常数为______________(带单位)
Ⅱ.若一开始就将K、F如图固定,其他条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为 _________________ ;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 ____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时才有I2析出。某课题组用0.02mol/LNaHSO3溶液和0.02mol/L KIO3溶液,以及淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式:__________________________。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
编号 | NaHSO3溶液(mL) | KIO3溶液(mL) | H2O(mL) | 反应温度(℃)/ | 变蓝时间(t/s) |
① | 10 | 15 | a | 10 | t1 |
② | 10 | 40 | 0 | 10 | t2 |
③ | 10 | b | 0 | 20 | t3 |
表中a=_________,b=_________。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。

①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应速率为_______mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你描述低于50℃时,溶液变蓝所需时间与反应温度的关系:__________________。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组在排除浓度、温度等影响因素后,对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;I2浓度越大反应速率越快;
假设二:________________________________________________________;
假设三:________________________________________________________;
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
实验方案 | 预期实验现象和结论 |
第一步:在烧杯甲中将NaHSO3溶液与过量KIO3 溶液混合, 用测速仪测定起始时的反应速率V(甲) 第二步:在烧杯乙中________________________,测定其起始阶段的相同时间内的反应速率V(乙) | 若__________,则假 设一成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017房山区二模】已知:用Pt﹣Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如图①、图②所示:下列说法中,不正确的是( )
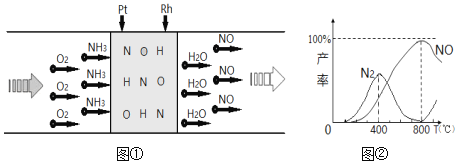
A.400℃时,生成的产物有N2、NO、H2O
B.800℃时,反应的化学方程式是:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C.400℃﹣800℃间,Pt﹣Rh合金对N2的吸附力逐渐减弱
D.800℃以上,发生了反应:2NO(g)O2(g)+N2(g)△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 根据对角线规则,铍和铝的性质具有相似性
B. 在H3O+、NH4+和[Cu(NH3)4]2+中都存在配位键
C. 元素电负性越大的原子,吸引电子的能力越强
D. P4和CH4都是正四面体分子且键角都为109o28ˊ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com