
(2)配制FeSO4溶液时,常加入少量铁粉,目的是__________________________;常加入少量H2SO4,目的是_________________________________________________________。
解析:(1)Na2S溶液中存在S2-的水解反应:
S2-+H2O![]() HS-+OH-
HS-+OH-
HS-+H2O![]() H2S+OH-
H2S+OH-
加入少量NaOH,加入了Na+,同时使上述平衡左移,因此可使N(Na+)∶N(S2-)=2∶1。
(2)FeSO4溶液中,Fe2+易被空气氧化为Fe3+:
4Fe2++O2+2H2O![]() 8/3Fe3++4/3Fe(OH)3↓
8/3Fe3++4/3Fe(OH)3↓
12Fe2++3O2+6H2O![]() 8Fe3++4Fe(OH)3↓
8Fe3++4Fe(OH)3↓
这样,加入铁粉,可使Fe3+转化为Fe2+:2Fe3++Fe![]() 3Fe2+,加入H2SO4可防止Fe(OH)3沉淀的生成。同时FeSO4又能发生水解反应:Fe2++2H2O
3Fe2+,加入H2SO4可防止Fe(OH)3沉淀的生成。同时FeSO4又能发生水解反应:Fe2++2H2O![]() Fe(OH)2+2H+,加入H2SO4可抑制Fe2+的水解。
Fe(OH)2+2H+,加入H2SO4可抑制Fe2+的水解。
答案:(1)NaOH(s)(或浓NaOH溶液) (2)使氧化生成的Fe3+转化为Fe2+ 反应掉氧化生成的Fe(OH)3,抑制Fe2+的水解


科目:高中化学 来源:宁夏银川一中2011-2012学年高二下学期期中考试化学试题 题型:022
硫化物通常有“废物”之称.硫化物据其溶解性可以分三类:
①易溶于水的有K2S、Na2S、(NH4)2S等;
②易溶于非氧化性强酸、不溶于水的有FeS、ZnS;
③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如HgS、Ag2S、CuS、Cu2S.其中,Ag2S、CuS、Cu2S能溶于硝酸发生氧化还原反应,而HgS只能溶于王水(硝酸与盐酸的混合液).氢硫酸溶液中存在下列平衡:
H2S(1)K2S溶液显________性,原因________(用离子方程式表示)K2S溶液中离子浓度由大到小顺序________
(2)推测将硫化氢通入硫酸铜溶液中生成硫酸的原因是________
(3)在氢硫酸溶液中改变下列条件,使溶液中.c(OH-)、c(S2-)都增大的是________
A.加入少量的漂白粉
B.通入氨气
C.加入少量过氧化钠粉末
D.加入少量硝酸银溶液
(4)已知在常温下FeS的Ksp=6.25×10-18,H2S饱和溶液中c(H+)与cS2-)之间存在如下关系:c2(H+)·(S2-)=1.0×10-22.在该温度下,将适量FeS入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H+)为________.
查看答案和解析>>
科目:高中化学 来源:上海市南汇中学2012届高三第一次考试化学试题 题型:022
1000℃时,在恒容密封容器中发生下列反应:Na2SO4(s)+4H2(g)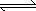 Na2S(s)+4H2O(g).
Na2S(s)+4H2O(g).
(1)该温度下,在2 L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g.则5分钟内H2的平均反应速率为________.
(2)能说明该反应已达到平衡状态的是________(填序号).
a.容器内压强保持不变
b.容器内气体密度保持不变
c.c(H2)=c(H2O)
d.v正(H2)=v逆(H2O)
(3)向该容器中分别加入以下物质,对平衡的影响如何?,(填“正向移动”,“逆向移动”或“不发生移动”)①加入少量Na2SO4固体,则平衡:________②加入少量灼热的碳粉,则平衡:________
(4)若将反应后的物质溶于水,用有关离子方程式说明上述反应产物水溶液的酸碱性________,欲使该溶液中S2-浓度增大,平衡逆向移动,可加入的物质是________.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市高三第一次考试化学试卷 题型:填空题
1000℃时,在恒容密封容器中发生下列反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。
则5分钟内H2的平均反应速率为 。
(2)能说明该反应已达到平衡状态的是____(填序号)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(H2)=c(H2O) d.v正(H2)=v逆(H2O)
(3)向该容器中分别加入以下物质,对平衡的影响如何?,(填“正向移动”,“逆向移动”或“不发生移动”)
①加入少量Na2SO4固体,则平衡: ②加入少量灼热的碳粉,则平衡:__
(4)若将反应后的物质溶于水,用有关离子方程式说明上述反应产物水溶液的酸碱性___ _,欲使该溶液中S2-浓度增大,平衡逆向移动,可加入的物质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化物通常有“废物”之称。硫化物据其溶解性可以分三类: ① 易溶于水的有 K2S 、Na2S 、(NH4)2S 等; ② 易溶于非氧化性强酸、不溶于水的有 FeS 、 ZnS ; ③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如 HgS 、 Ag2S 、 CuS 、 Cu2S 。其中,Ag2S、 CuS 、 Cu2S 能溶于硝酸发生氧化还原反应,而 HgS只能溶于王水(硝酸与盐酸的混合液)。氢硫酸溶液中存在下列平衡:
H2S ![]() H ++ HS-, HS-
H ++ HS-, HS- ![]() H + + S2-。
H + + S2-。
(1)K2S溶液显___________性,原因______________________(用离子方程式表示)
K2S溶液中离子浓度由大到小顺序____________________________________________
(2)推测将硫化氢通入硫酸铜溶液中生成硫酸的原因是___________________________
(3)在氢硫酸溶液中改变下列条件,使溶液中。c(OH-)、c(S2-)都增大的是______
A.加入少量的漂白粉 B.通入氨气
C.加入少量过氧化钠粉末 D.加入少量硝酸银溶液
(4)已知在常温下 FeS 的Ksp=6.25 ×10-18,H2S饱和溶液中c(H+)与c S2-)之间存在如下关系:c2(H+)·(S2-)= 1.0×10-22 。在该温度下,将适量FeS 入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________ 。
查看答案和解析>>
科目:高中化学 来源:2012届上海市南汇中学高三第一次考试化学试卷 题型:填空题
1000℃时,在恒容密封容器中发生下列反应:Na2SO4(s)+4H2(g)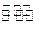 Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。
则5分钟内H2的平均反应速率为 。
(2)能说明该反应已达到平衡状态的是____(填序号)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(H2)=c(H2O) d.v正(H2)=v逆(H2O)
(3)向该容器中分别加入以下物质,对平衡的影响如何?,(填“正向移动”,“逆向移动”或“不发生移动”)
①加入少量Na2SO4固体,则平衡: ②加入少量灼热的碳粉,则平衡:__
(4)若将反应后的物质溶于水,用有关离子方程式说明上述反应产物水溶液的酸碱性___ _,欲使该溶液中S2-浓度增大,平衡逆向移动,可加入的物质是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com