
 )主要用于制备香辛樱桃、杏、蜂蜜等香料.
)主要用于制备香辛樱桃、杏、蜂蜜等香料.

 (任写一个即可).
(任写一个即可). 分析 (1)由结构可知分子式;
(2)香豆酸中含酚-OH、碳碳双键、-COOH,结合酚、烯烃、羧酸的性质来解答;
(3)由转化关系可知,氯代乙苯在NaOH溶液中水解生成甲为苯乙醇,甲发生消去反应生成乙为苯乙烯,苯乙烯氧化生成丙,最后丙发生酯化反应生成丁为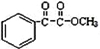 ;
;
(4)丁为 ,戊与丁互为同分异构体,且满足以下特点:①是苯的对位取代物,苯环上对位的H被取代;②能与NaHCO3反应放出气体,含-COOH;③能发生银镜反应,含-CHO,则在苯环的对位有2个取代基,分别含-CHO、-COOH.
,戊与丁互为同分异构体,且满足以下特点:①是苯的对位取代物,苯环上对位的H被取代;②能与NaHCO3反应放出气体,含-COOH;③能发生银镜反应,含-CHO,则在苯环的对位有2个取代基,分别含-CHO、-COOH.
解答 解:(1)由结构可知分子式为C9H8O3,故答案为:C9H8O3;
(2)香豆酸中含酚-OH、碳碳双键、-COOH,则
a.含酚-OH、-COOH,均能与NaOH溶液反应,故正确;
b.含-OH、-COOH可发生取代反应,含碳碳双键能发生加成反应,但不含-CHO,则不能发生银镜反应,故错误;
c.含酚-OH、-COOH,均加金属钠,有氢气生成,故正确;
d.含酚-OH,加FeCl3溶液,溶液显紫色,故正确;
故答案为:b;
(3)由转化关系可知,氯代乙苯在NaOH溶液中水解生成甲为苯乙醇,甲发生消去反应生成乙为苯乙烯,苯乙烯氧化生成丙,最后丙发生酯化反应生成丁为 ;
;
①由上述分析可知,甲→乙的反应类型为消去反应,故答案为:消去反应;
②丙→丁的反应化学方程式为 ,故答案为:
,故答案为: ;
;
(4)丁为 ,戊与丁互为同分异构体,且满足以下特点:①是苯的对位取代物,苯环上对位的H被取代;②能与NaHCO3反应放出气体,含-COOH;③能发生银镜反应,含-CHO,则在苯环的对位有2个取代基,分别含-CHO、-COOH,所以化合物戊的结构简式为
,戊与丁互为同分异构体,且满足以下特点:①是苯的对位取代物,苯环上对位的H被取代;②能与NaHCO3反应放出气体,含-COOH;③能发生银镜反应,含-CHO,则在苯环的对位有2个取代基,分别含-CHO、-COOH,所以化合物戊的结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断及结构与性质,为高频考点,把握官能团与性质的关系、转化中官能团的变化、有机反应等为解答的关键,(4)为解答的难点,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 进行焰色反应实验操作时,每次实验后要将铂丝用盐酸洗净 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③ | C. | ②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +2H2O
+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲温度不变、乙降低温度 | |
| B. | 甲中加入0.1mol He,乙不改变 | |
| C. | 甲增加0.1mol H2,乙增加0.1mol I2(g) | |
| D. | 甲降低温度,乙温度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 腐蚀中正极反应为:2H++2e-=H2↑ | |
| B. | 腐蚀中负极反应为:Fe-3e-=Fe3+ | |
| C. | 钢铁设备上连接铜块可以防止腐蚀 | |
| D. | 钢铁与外加直流电源的正极相连可以防止腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com