
| A. | 扩大容器的容积,平衡向正反应方向移动 | |
| B. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 加入水蒸气使容器压强增大,平衡向逆反应方向移动 | |
| D. | 加入固体碳,平衡向正反应方向移动 |
分析 A、扩大容器的容积,减小压强,化学平衡向着气体体积增大的方向进行;
B、升高温度,所有化学反应速率都会加快;
C、增加反应物的浓度是使得化学平衡正向移动;
D、固体量的增减不会引起化学平衡的移动.
解答 解:A、扩大容器的容积,减小压强,化学平衡向着气体体积增大的方向即正方向移动,故A正确;
B、升高温度,所有化学反应的正逆反应速率都会加快,故B错误;
C、增加反应物水的浓度会使得化学平衡正向移动,故C错误;
D、固体C的量的增减不会引起化学平衡的移动,故D错误;
故选A.
点评 化学平衡的移动受到温度、浓度、压强等因素的影响,注意固体量的增减不会引起化学平衡的移动这一点是关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
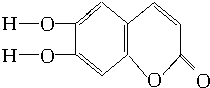 (C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
(C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )| A. | 3 mol Br2、2 mol NaOH | B. | 3 mol Br2、4 mol NaOH | ||
| C. | 2 mol Br2、3 mol NaOH | D. | 4 mol Br2、4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
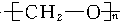 ,它是通过加聚反应制得的,则合成象牙的单体是( )
,它是通过加聚反应制得的,则合成象牙的单体是( )| A. | (CH3)2O | B. | CH3CHO | C. | HCHO | D. | C2H2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
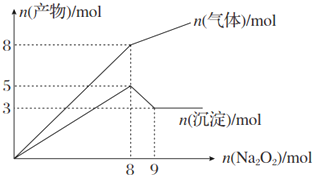
| A. | 2 mol、3 mol、4 mol | B. | 2 mol、3 mol、8 mol | ||
| C. | 3 mol、2 mol、8 mol | D. | 3 mol、2 mol、4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.18g | B. | 2.12g | C. | 4.22g | D. | 5.28g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com