
(8��)��֪��1mol�����еĻ�ѧ����Ҫ����436kJ��������1mol�����еĻ�ѧ����Ҫ����498kJ����������ͼ�е�����ͼ���ش��������⣺
��1���ֱ�д���٢ڵ���ֵ��
�� �� �� �� �� ��
��2������H2O��g���е�1mol H-O���ų� �� kJ��������
��3����֪��H2O��l��= H2O��g�� DH = +44 kJ��mol��1 ����д����������������ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ�� �� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��09��10��̨���и߶���ѧ����ĩ���Ի�ѧ�� ���ͣ������
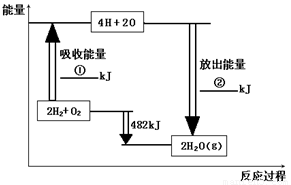
(8��)��֪��1mol�����еĻ�ѧ����Ҫ����436kJ��������1mol�����еĻ�ѧ����Ҫ����498kJ����������ͼ�е�����ͼ���ش��������⣺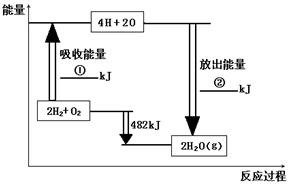
��1���ֱ�д���٢ڵ���ֵ��
�� �� �� �� �� ��
��2������H2O��g���е�1mol H-O���ų� �� kJ��������
��3����֪��H2O��l��= H2O��g�� DH=" +44" kJ��mol��1����д����������������ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ�� �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ��ͨ�к����ظ߶���ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ�ʵ����
��12�֣��ڻ�ѧ��ѧ�о��У����ʷ�����ѧ��Ӧ�ķ�Ӧ�ȿ�ͨ��ʵ��ⶨ��Ҳ��ͨ����ѧ����ķ�ʽ��ӵػ�á�
��ʵ�鷽���ⷴӦ��Ӧ��
���к��Ȳⶨ
ʵ��������Ҫʹ�õIJ����������ձ�����Ͳ���Ҫ �� ��
Ϊ�˼���ʵ����ʵ������н�NaOH��Һ ��ѡ�һ�Ρ��ֶ�Ρ�������ʢ�������С�ձ��У���Һ��Ϻ�ȷ��ȡ�����Һ�� ����Ϊ��ֹ�¶ȡ�
��ʵ��ⶨ��һ���¶��£�0.2 molCH4(g)������H2O(g)��ȫ��Ӧ����CO2(g)��H2(g)����33 kJ���������÷�Ӧ���Ȼ�ѧ����ʽ ��
��ͨ����ѧ�����ӻ��
����֪��1mol��H��H����I��I��H��I���ֱ���Ҫ���յ�����Ϊ436kJ��153kJ��299kJ��
��ӦH2(g)��I2(g)��2HI(g)�ķ�Ӧ�ȡ�H�� kJ��mol��1
�ڹ�ҵ�����״��ij��÷����ǣ�CO(g)+2H2(g)��CH3OH(g) ��H����90.8 kJ��mol��1��
��֪��2H2(g)+ O2(g) �� 2H2O (l) ��H����571.6 kJ��mol��1
H2(g)+ O2(g) �� H2O(g) ��H����241.8 kJ��mol��1
O2(g) �� H2O(g) ��H����241.8 kJ��mol��1
����������Ӧȷ����H2ȼ����Ϊ kJ��mol��1��
CH3OH(g)��O2(g) �� CO(g)��2H2O(g) ��H�� kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�콭��ʡ��ͨ�к����ظ߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
��12�֣��ڻ�ѧ��ѧ�о��У����ʷ�����ѧ��Ӧ�ķ�Ӧ�ȿ�ͨ��ʵ��ⶨ��Ҳ��ͨ����ѧ����ķ�ʽ��ӵػ�á�
��ʵ�鷽���ⷴӦ��Ӧ��
���к��Ȳⶨ
ʵ��������Ҫʹ�õIJ����������ձ�����Ͳ���Ҫ �� ��
Ϊ�˼���ʵ����ʵ������н�NaOH��Һ ��ѡ�һ�Ρ��ֶ�Ρ�������ʢ�������С�ձ��У���Һ��Ϻ�ȷ��ȡ�����Һ�� ����Ϊ��ֹ�¶ȡ�
��ʵ��ⶨ��һ���¶��£�0.2 molCH4(g)������H2O(g)��ȫ��Ӧ����CO2(g)��H2(g)����33 kJ���������÷�Ӧ���Ȼ�ѧ����ʽ ��
��ͨ����ѧ�����ӻ��
����֪��1mol��H��H����I��I��H��I���ֱ���Ҫ���յ�����Ϊ436kJ��153kJ��299kJ��
��ӦH2(g)��I2(g)��2HI(g)�ķ�Ӧ�ȡ�H�� kJ��mol��1
�ڹ�ҵ�����״��ij��÷����ǣ�CO(g)+2H2(g)��CH3OH(g) ��H����90.8 kJ��mol��1��
��֪��2H2(g)+ O2(g) �� 2H2O (l) ��H����571.6 kJ��mol��1
H2(g)+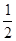 O2(g) �� H2O(g)
��H����241.8 kJ��mol��1
O2(g) �� H2O(g)
��H����241.8 kJ��mol��1
����������Ӧȷ����H2ȼ����Ϊ kJ��mol��1��
CH3OH(g)��O2(g) �� CO(g)��2H2O(g) ��H�� kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��09-10��̨���и߶���ѧ����ĩ���Ի�ѧ�� ���ͣ������
(8��)��֪��1mol�����еĻ�ѧ����Ҫ����436kJ��������1mol�����еĻ�ѧ����Ҫ����498kJ����������ͼ�е�����ͼ���ش��������⣺
��1���ֱ�д���٢ڵ���ֵ��
�� �� �� �� �� ��
��2������H2O��g���е�1mol H-O���ų� �� kJ��������
��3����֪��H2O��l��= H2O��g�� DH = +44 kJ��mol��1 ����д����������������ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ�� �� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com