
 利用如图所示装置进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置进行下列实验,不能得出相应实验结论的是( )| 选项 | ① | ② | ③ | ③中的现象 |
| A | 浓盐酸 | Na2SO3 | BaCl2溶液 | 出现浑浊 |
| B | 稀盐酸 | 石灰石 | 饱和Na2CO3溶液 | 出现浑浊 |
| C | 浓氨水 | 生石灰 | 酚酞溶液 | 出现红色 |
| D | 醋酸 | 贝壳 | 澄清石灰水 | 先浑浊后澄清 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓盐酸与亚硫酸钠反应生成二氧化硫,二氧化硫不与氯化钡反应,则不会出现白色沉淀;
B.碳酸钠的溶解度大于碳酸氢钠,则①②生成的二氧化碳通入③中会析出碳酸氢钠晶体;
C.生石灰与水反应生成氢氧化钙,浓氨水中企业广告离子浓度增大,且该反应为放热反应,导致②中生成氨气,氨气为碱性气体,能够使酚酞溶液变红;
D.醋酸与贝壳反应生成二氧化碳气体,二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀,二氧化碳过量后碳酸钙沉淀溶解.
解答 解:A.①②反应生成二氧化硫气体,二氧化硫不与③中的氯化钡溶液反应,则③中不会生成白色沉淀,不会得出该结论,故A正确;
B.①②反应生成二氧化碳气体,二氧化碳通入③饱和碳酸钠溶液中会析出碳酸氢钠固体,所以③中会出现浑浊,能够得出该结论,故B错误;
C.生石灰与浓氨水能够生成氨气,氨气为碱性气体,所以氨气通入③中后酚酞溶液变红,能够得出该结论,故C错误;
D.①②反应生成二氧化碳气体,二氧化碳能够使③中澄清石灰水变浑浊,当二氧化碳过量后碳酸钙沉淀溶解,所以③中先变浑浊后澄清,能够得出结论,故D错误;
故选A.
点评 本题考查了实验装置的综合应用,题目难度中等,明确常见物质性质及发生反应原理为解答关键,注意掌握常见装置特点及应用方法,试题培养了学生的化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L溶液中含有Imol NaOH | B. | 溶液中含有Imol NaOH | ||
| C. | 1L水中含有Imol NaOH | D. | 将40克NaOH溶于1L水中所得的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
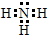 ;画出碳原子结构示意图
;画出碳原子结构示意图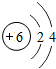 ;氧元素位于周期表第周期第VIA族.
;氧元素位于周期表第周期第VIA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的醋酸溶液稀释100倍后,溶液的pH=5 | |
| B. | pH=2的盐酸与等体积0.01mol•L-1醋酸钠混合溶液后,溶液中c(Cl-)=c(CH3COO-) | |
| C. | 0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)>c(I-) | |
| D. | 氨水中通入过量CO2后,溶液中c(H+)+c(NH4+)=c(OH-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
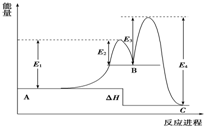 某反应由两步反应A═B═C构成,它的反应能量曲线如图(E1、E3表示活化能).下列有关叙述正确的是( )
某反应由两步反应A═B═C构成,它的反应能量曲线如图(E1、E3表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 三种化合物中C最稳定 | ||
| C. | 加入催化剂会改变反应的焓变 | D. | 整个反应的△H=E1-E 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量 Cu(NO3)2溶液 | |
| B. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| C. | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反 应的△S<0 | |
| D. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +4 | B. | +2 | C. | +6 | D. | +3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com