
下列对于硝酸的认识,不正确的是( )
A.浓硝酸和稀硝酸都具有氧化性
B.铜与硝酸的反应属于置换反应
C.硝酸可氧化Fe2+
D.常温下可用铁或铝制品盛装浓硝酸
科目:高中化学 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是 ( )
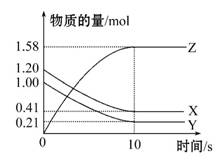
A.反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B.10 s后,该反应停止进行
C.反应的化学方程式为2X(g)+Y(g) 2Z(g)
2Z(g)
D.反应开始到10 s时,平衡反应速率:v(X)=v(Y)=0.039 5 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为____________________。
(3)实验①和②的目的是_________________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_______________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。

分析上图能够得出的实验结论是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.硫是一种淡黄色的不溶于水的晶体
B.硫的化合物常存在于火山喷发的气体中和矿泉水中
C.单斜硫和斜方硫都是硫单质
D.硫在空气中燃烧的产物是SO2,在纯氧中的燃烧产物是SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在空气中加热S粉和Fe粉的混合物,可观察到下列现象,请写出有关反应方程式。
(1)有淡蓝色火焰,且生成刺激性气味的气体________________________________。
(2)混合粉末变红,放出热量,最后变为黑色固体________________________________。
(3)不时有火星从混合物中射出______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列反应中,HNO3既表现氧化性,又表现酸性的是( )
A.H2S+2HNO3===S↓+2NO2↑+2H2O
B.CuO+2HNO3===Cu(NO3)2+H2O
C.4HNO3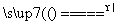 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
D.3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
装置Ⅰ和装置Ⅱ、装置Ⅲ是有关硝酸和铜反应的实验装置示意图:
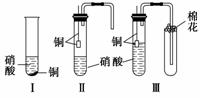
(1)若用装置Ⅰ进行铜与浓硝酸反应的实验,最大的缺点是____________________;
若用装置Ⅰ来证明铜与稀硝酸反应生成NO气体,其最大缺点是不能与浓硝酸跟铜反应形成鲜明对照。简述原因_____________________________________________________。
(2)若用装置Ⅱ进行适当操作,即可克服上述缺点,还能使上述两反应在同一试管中先后连续进行。实验步骤如下:
步骤一:组装好装置并______________后,加入2 mL浓硝酸(铜片接近酸液),塞紧胶塞。
步骤二:________________(操作)使反应发生。当导管口有少量红棕色气体逸出时,__________________________________________(操作)使反应停止。同时将导管插入水中。稍后能观察到:a.水沿导管倒吸至试管中;还可能观察到下列________(填序号)等明显现象;b.溶液由蓝色变为无色;c.铜片表面产生气泡;d.红棕色气体变为无色。请解释产生现象a的原因________________________________________________________________________
________________________________________________________________________。
步骤三:当试管中溶液体积约占试管容积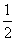 时,此时铜片与溶液接触,从水中抽出导管,并伸入一试管中,管口塞上浸有浓碱液的棉花(如装置Ⅲ)。这样做的目的是_______和__________________。
时,此时铜片与溶液接触,从水中抽出导管,并伸入一试管中,管口塞上浸有浓碱液的棉花(如装置Ⅲ)。这样做的目的是_______和__________________。
步骤四:反应完毕后……
(3)上述实验“步骤四”中反应完毕后还需要进行的操作是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列化学反应和事实,说明反应利用了硫酸的什么性质,将表示性质的选项的字母填在各小题的横线上。
A.不挥发性 B.酸性
C.吸水性 D.脱水性
E.强氧化性 F.强酸性
(1)浓硫酸可作气体干燥剂________;
(2)蔗糖中加浓H2SO4产生“黑面包”现象________;
(3)2NaCl+H2SO4(浓)Na2SO4+2HCl↑________;
(4)Zn+H2SO4(稀)===ZnSO4+H2↑________;
(5)Na2SO3+H2SO4(稀)===Na2SO4+SO2↑+H2O________;
(6)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O________;
(7)C+2H2SO4(浓)2SO2↑+2H2O+CO2↑________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com