
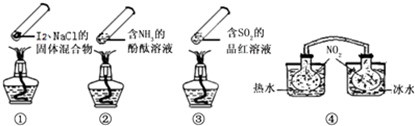
| A、加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 |
| B、加热时,②、③中的溶液均变红,冷却后又都变为无色 |
| C、④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D、四个“封管实验”中都有可逆反应发生 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
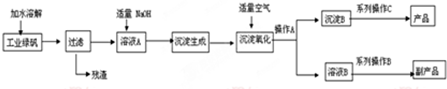
查看答案和解析>>
科目:高中化学 来源: 题型:
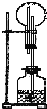
| A、块状大理石和稀硫酸 |
| B、NH4Cl与稀NaOH溶液 |
| C、Na2O2与NaOH溶液 |
| D、铜片与稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
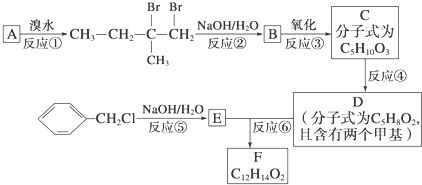
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该离子液体中含氨分子 |
| B、硝酸乙基铵水溶液呈碱性 |
| C、硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++2H2O?C2H5NH2?H2O+H3O+ |
| D、同温度下相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH:②>③>④>① |
| B、c(CH3COO-):②>④>③>① |
| C、溶液中c(H+):①>③>②>④ |
| D、c(CH3COOH):①>④>③>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com