
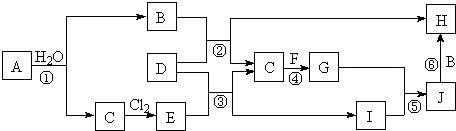
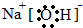 ��
������ ת����ϵ�и����ʾ�Ϊ����������Ԫ����ɵĵ��ʻ������������G����ʹʪ��ĺ�ɫʯ����ֽ��������GΪNH3����Ӧ���ǹ�ҵ�ƻ��ʵ���Ҫ��Ӧ֮һ���Ǻϳɰ���C��F�ֱ�ΪN2��H2�е�һ�֣�����A����ˮ��Ӧ�õ�B��C����B����ɫ��Ӧ�ʻ�ɫ������֪AΪNa��BΪNaOH��CΪH2����FΪN2��C��������Ӧ����EΪHCl������D������B��NaOH��������E��HCl����Ӧ����C������������DΪAl��HΪNaAlO2��IΪAlCl3���ɷ�Ӧ�ݿ�֪JΪAl��OH��3��������Һ���ᣬ����������������Һ��Ӧ�õ�ƫ�����ƣ��ݴ˽��
��� �⣺ת����ϵ�и����ʾ�Ϊ����������Ԫ����ɵĵ��ʻ������������G����ʹʪ��ĺ�ɫʯ����ֽ��������GΪNH3����Ӧ���ǹ�ҵ�ƻ��ʵ���Ҫ��Ӧ֮һ���Ǻϳɰ���C��F�ֱ�ΪN2��H2�е�һ�֣�����A����ˮ��Ӧ�õ�B��C����B����ɫ��Ӧ�ʻ�ɫ������֪AΪNa��BΪNaOH��CΪH2����FΪN2��C��������Ӧ����EΪHCl������D������B��NaOH��������E��HCl����Ӧ����C������������DΪAl��HΪNaAlO2��IΪAlCl3���ɷ�Ӧ�ݿ�֪JΪAl��OH��3��������Һ���ᣬ����������������Һ��Ӧ�õ�ƫ�����ƣ�
��1��������������֪��F�Ļ�ѧʽΪ��N2���ʴ�Ϊ��N2��
��2��BΪNaOH���������������������ӹ��ɣ������ʽΪ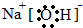 ���ʴ�Ϊ��
���ʴ�Ϊ��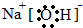 ��
��
��3����Ӧ�ٵĻ�ѧ����ʽΪ��2Na+2H2O=2NaOH+H2�����ʴ�Ϊ��2Na+2H2O=2NaOH+H2����
��4����Ӧ�ڵ����ӷ���ʽΪ��2Al+2OH-+2H2O�T2AlO2-+3H2�����ʴ�Ϊ��2Al+2OH-+2H2O�T2AlO2-+3H2����
���� ���⿼�������ƶϣ������ʵ�״̬����̬Gʹʪ��ĺ�ɫʯ����ֽ�����������ƶ�ͻ�ƿڣ��ٽ��ת����ϵ�е����ⷴӦ�����ƶϣ���Ҫѧ����������Ԫ�ػ�����֪ʶ���Ѷ��еȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
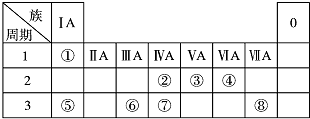 ���ΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã��ش��������⣺
���ΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã��ش��������⣺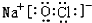 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
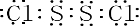 �����廯����E2D2Ͷ�뵽������E2L��ˮ��Һ�У�ֻ�۲쵽�г��������ģ�д���÷�Ӧ�����ӷ���ʽΪ��Na2O2+Na2S+2H2O=S+4NaOH��
�����廯����E2D2Ͷ�뵽������E2L��ˮ��Һ�У�ֻ�۲쵽�г��������ģ�д���÷�Ӧ�����ӷ���ʽΪ��Na2O2+Na2S+2H2O=S+4NaOH�� 2SO3��g����H=-197KJ/mol��
2SO3��g����H=-197KJ/mol���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������Ȼ�̼ | B�� | ��������Ҵ� | ||
| C�� | ��������ˮ | D�� | �����屽 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
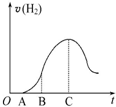 �ѷ��ڿ�����һ��ʱ���5.0g��ƬͶ��ʢ��500mL 0.5mol•L-1������Һ���ձ��У�����Ƭ�����ᷴӦ���������������뷴Ӧʱ�������ͼ��������������ʾ���ش��������⣺
�ѷ��ڿ�����һ��ʱ���5.0g��ƬͶ��ʢ��500mL 0.5mol•L-1������Һ���ձ��У�����Ƭ�����ᷴӦ���������������뷴Ӧʱ�������ͼ��������������ʾ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol/LNaHCO3��Һ��0.1mol/LNaOH��Һ�������ϣ�������Һ�У�c��Na+����c��CO32-����c��OH-����c��HCO3-�� | |
| B�� | 20mL0.1mol/LCH3COONa��Һ��10mL0.1mol/LHCl��Һ��Ϻ�����ԣ�������Һ�У�c��CH3COO-����c��Na+����c��CH3COOH����c��H+�� | |
| C�� | �����£�pH=2��������pH=12�İ�ˮ�������ϣ�������Һ�У�c��Cl-����c��H+����c��NH4+����c��OH-�� | |
| D�� | 0.1mol/LCH3COOH��Һ��0.1mol/LNaOH��Һ�������ϣ�������Һ�У�c��OH-����c��H+��+c��CH3COOH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com