
实验室利用如图装置进行中和热的测定。回答下列问题:
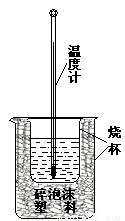
(1)该图中有两处实验用品未画出,它们是 、 ;
(2)在操作正确的前提下提高中和热测定的准确性的关键是: 。
(3)如果用0.5mol?L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将 (填“偏大”、“偏小”、“不变”)原因是 。
科目:高中化学 来源:2015届安徽省同步课时练(人教选修4)1.2 燃烧热能源试卷(解析版) 题型:选择题
关于能源,以下说法中不正确的是( )
A.煤、石油、天然气等燃料属不可再生能源
B.煤、石油、水煤气可从自然界直接获取,属一级能源
C.太阳能是一级能源、新能源、可再生能源
D.潮汐能来源于月球引力做功
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)2.3化学平衡移动试卷(解析版) 题型:选择题
已知反应:A(g)+3B(g)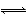 2C(g)是放热反应,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
2C(g)是放热反应,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是( )
A.正反应速率增大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小,平衡向正反应方向移动
D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)1.3化学反应热的计算(解析版) 题型:填空题
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652 kJ的热量。
(1)反应的热化学方程式为 。
(2)已知H2O(l) H2O(g) ΔH=+44 kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
H2O(g) ΔH=+44 kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g) 2NO2(g) ΔH=+67.7 kJ·mol-1
2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
肼和二氧化氮反应的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)1.3化学反应热的计算(解析版) 题型:选择题
在298 K、100 kPa时,已知:
2H2O(g) 2H2(g)+O2(g) ΔH1
2H2(g)+O2(g) ΔH1
Cl2(g)+H2(g) 2HCl(g) ΔH2
2HCl(g) ΔH2
2Cl2+2H2O(g) 4HCl(g)+O2(g) ΔH3
4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH2和ΔH1之间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:选择题
在相同条件下(T=500K),相同体积的甲乙两容器,甲中充入1gSO2和1gO2,乙中充入2gSO2和2gO2,下列叙述中不正确的是( )
A.反应速率:乙>甲 B.平衡混合物中SO2的体积分数:乙>甲
C.SO2的转化率:乙>甲 D.平衡时O2的浓度:乙>甲
查看答案和解析>>
科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:选择题
对于可逆反应A(g)+2B(g) 2C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是( )
2C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是( )
A.增大压强 B.减少B的浓度 C.减少A的浓度 D.升高温度
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期第一次月考理综试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中正确的有
①标准状况下,20 g重水(D2O)中含有的电子数为10NA
②0.5 mol Fe2+与足量的H2O2溶液反应,转移0.5 NA个电子
③将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA
④乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
⑤2 mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1 mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4 L的N2的共用电子对数为3NA
A.3个B.4个C.5个D.全部正确
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都市2012级临诊考试化学试卷(解析版) 题型:填空题
(12分)某小组进行铝热反应实验,装置如图所示。

(1)铝热反应原理____(写化学方程式);试剂A为____(写化学式).实验现象____、有黑色固体生成。
(2)对黑色固体物质的组成,小组进行了如下探究
假设I该黑色物质为铁
假设Ⅱ该黑色物质为铁与四氧化三铁的混合物
【设计方案并实验】
实 验 步 骤 | 现 象 | 结 论 |
①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设Ⅱ不成立 |
②滴入几滴0.01mol/LKSCN溶液 | 溶液不变色 |
【交流评价】
你认为上述结论是否合理,__ __理由是__ __。
(3)取上述实验所得溶液,滴人适量氯水溶液变红色。此时涉及的离子反应方程式为
__ __、__ __;
利用反应体系中存在的平衡,小组再将溶液均分置于两支试管中并分别编号l、2.进行
如下探究:
实验编号 | 实验步骤 |
1 | ①滴加饱和FeCl3溶液4滴,充分振荡 |
②滴加几滴NaOH溶液 | |
| ①滴加4滴1mol/LKSCN溶液 |
②滴加几滴NaOH溶液 |
该实验中,小组
主要探究的问题是__ __;
应重点观察的现象是__ __
预计得出的结论是__ __。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com