
| A. | 100体积的水和100体积的酒精混合,所得混合溶液的体积等于200体积 | |
| B. | 串联电路中电流大小处处相等 | |
| C. | 稀盐酸和氢氧化钠溶液混合后,所得溶液质量与反应前溶液的总质量相等 | |
| D. | 在化学反应中,反应物的原子种类和总数等于生成物的原子种类和总数 |
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4和浓HCl在空气中敞口放置时浓度均减小 | |
| B. | SO2和Cl2均能使品红溶液褪色 | |
| C. | 浓H2SO4和稀硫酸与锌反应均生成气体 | |
| D. | 浓H2SO4、浓HNO3均可以用铁制容器贮存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl=NaCl+H2O | |
| B. | Zn+2HCl=ZnCl2+H2 | |
| C. | BaCO3+2HCl=BaCl2+H2O+CO2↑ | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于碘在酒精中的溶解度大,所以,可用酒精把碘水中的碘萃取出来 | |
| B. | 水的沸点是100℃,酒精的沸点是78.5℃,所以,可用加热蒸馏方法使含水酒精变成无水酒精 | |
| C. | 氯化钠的溶解度随着温度下降而减少,所以,用冷却法从热的含有少量硝酸钾浓溶液中得到纯净的氯化钠晶体 | |
| D. | 在实验室中,通常采用加热氯酸钾和二氧化锰的混合物方法制取氧气.我们可以用溶解.过滤的方法从反应产物中得到二氧化锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂、方法 |
| A | O2 | 水蒸气 | 通过浓H2SO4洗气 |
| B | MnO2 | 炭粉 | 在空气中灼烧 |
| C | KCl溶液 | BaCl2 | 加入适量的Na2SO4溶液,过滤 |
| D | FeSO4溶液 | CuSO4 | 加入足量铁屑,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子层数越多,原子半径越大 | |
| B. | 每一主族所含非金属元素的种类可表示为︳族序数-2? | |
| C. | 根据泡利原理将氧元素基态原子的电子排布图书写为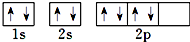 | |
| D. | C2H2分子中的碳采取sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com