
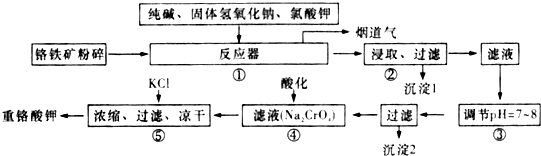
分析 (1)钠离子、钾离子的检验方法是焰色反应;
(2)硅酸钠和偏铝酸钠易发生水解,根据水解平衡移动原理来回答;
(3)二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳;
(4)利用盖斯定律计算反应热,并书写热化学方程式,甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l),△H1=-1451kJ/mol;
②2H2(g)+O2(g)═2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式$\frac{3}{2}$×②-①×$\frac{1}{2}$;
(5)①用Fe为阳极进行电解,总反应:Fe+2H+═Fe2++H2↑;
Cr2O72-将亚铁离子氧化为铁离子反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,Fe3+、Cr3+结合氢氧根离子最终转化为Fe(OH)3、Cr(OH)3沉淀,把以上方程式加合可得电解法处理废水的总反应的离子方程式6Fe+Cr2O72-+2H++17H2O=6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②根据Cr(OH)3的Ksp=6.3×10-31=c(Cr3+)×c3(OH-)计算.
解答 解:(1)⑤中溶液金属阳离子为钠离子、钾离子,检验方法是焰色反应,
故答案为:焰色反应;
(2)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
故答案为:SiO32-,AlO2-;
(3)二氧化硅与碳酸钠反应生成硅酸钠和二氧化碳,该反应为SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2,
故答案为:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2;
(4)甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l),△H1=-1451kJ/mol;
②2H2(g)+O2(g)═2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式$\frac{3}{2}$×②-①×$\frac{1}{2}$;所以△H=×(-571.6kJ/mol)-(-1451kJ/mol)×$\frac{1}{2}$=-131.9kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9kJ/mol;
(5)①用Fe为阳极进行电解,总反应:$\frac{3}{2}$H2↑;
Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,Cr2O72-与Fe2+反应的过程中,都将消耗大量的H+,使溶液pH上升,促使Fe3+、Cr3+结合氢氧根离子最终转化为Fe(OH)3、Cr(OH)3沉淀,综上可得:电解法处理废水的总反应的离子方程式6Fe+Cr2O72-+2H++17H2O=6Fe(OH)3↓+2Cr(OH)3↓+6H2↑,故答案为:6Fe+Cr2O72-+2H++17H2O=6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②,若地表水铬含量最高限值是0.1mg/L,换算成物质的量浓度c(Cr3+)=$\frac{1×1{0}^{-4}}{52}$mol/L,要使溶液中c(Cr3+)降到符合地表水限值,已知Cr(OH)3的Ksp=6.3×10-31=c(Cr3+)×c3(OH-),须调节溶液的c(OH-)≥$\sqrt{\frac{{6.3×{{10}^{-31}}}}{{\frac{{1×{{10}^{-4}}}}{52}}}}$mol/L,故答案为:$\sqrt{\frac{{6.3×{{10}^{-31}}}}{{\frac{{1×{{10}^{-4}}}}{52}}}}$.
点评 本题考查较为综合,涉及氧化还原反应、电解原理、盖斯定律、化学计算、物质检验等知识点,需要学生具备扎实的基础知识,平时注意培养分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:填空题
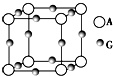 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中金属共失去电子0.1 mol | |
| B. | 合金中,铜的质量为2.8 g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5 mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5 mol•L-1的NaOH溶液60 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
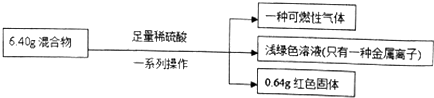
| A. | 原混合物中铜元素的质量一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为87.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内生成a mol A,同时生成3a mol B | |
| C. | A、B、C的浓度不再变化 | |
| D. | 混合气体的总压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 钠与水的反应 Na+2H2O═Na++2OH-+H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO${\;}_{4}^{2-}$+2OH-+Ba2+═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ②③ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com