
【题目】能在溶液中大量共存的一组离子是
A. NH4+、Ag+、PO43-、Cl- B. Fe3+、H+、I-、 HCO3-
C. K+、 Na+、 NO3-、 MnO4- D. Al3+、Mg2+、SO42-、CO32-
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】对于恒容密闭容器中发生的可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为
2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为
A. 断开一个N≡N键的同时有6个N—H键生成
B. 混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D. N2、H2、NH3分子数比为1∶3∶2的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中:①NaCl;②NaOH;③NH3·H2O;④CH3COOH溶液;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4;⑨CO2;⑩酒精溶液(均填写编号回答)
(1)pH相等的②的溶液和③的溶液等体积加水稀释相同倍数后,pH大的是______.
(2)有pH均为2的④、⑦、⑧三种物质的溶液,物质的量浓度大到小的顺序为______,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是__________.
(3)某温度时,1mol·L-1的醋酸溶液电离平衡常数为1.0×10-8,达平衡时,溶液中氢离子浓度是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液
(1)实验测得0.1 mol·L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka= ;
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为 ;
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为 ;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是 ;
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中正确的是( )
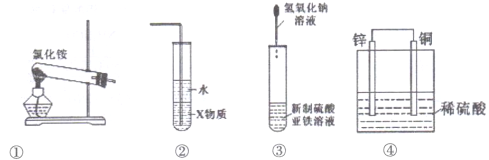
A. 装置①可用于实验室用制取氨气
B. 装置②中X若为四氯化碳,可用于吸收氨气
C. 装置③可用于制备氢氧化亚铁并观察其颜色
D. 装置④是原电池,锌电极为负极,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。A是所有元素中原子半径最小的元素。B、C、D同周期且相邻,C的气态氢化物的水溶液显碱性。E是同周期元素中金属性最强的元素。F的氧化物既能溶于强酸又能溶于强碱。G的一种氧化物能使品红溶液褪色,且G原子的M层电子数是K层电子数的3倍。按要求回答下列向题:
(1) C元素在周期表中位置_________;F原子的原子结构示意图是________。
(2)E与D形成的化合物E2D2的电子式是_______;B与D形成的化合物BD2的结构式是_____。
(3)B、G、H三种元素最高价氧化物的水化物的酸性从强到弱的顺序是________。E所在的周期中离子半径最小的是________。(用相应酸的化学式或离子符号回答问题)
(4)G的一种氧化物能使酸性高锰酸钾溶液褪色,对应的离子方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com