
 Ⅰ.下列实验方案不可行的是:
Ⅰ.下列实验方案不可行的是:| n |
| V |


科目:高中化学 来源: 题型:
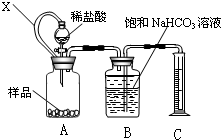 某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:
某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
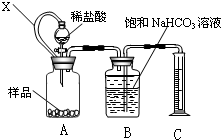 某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:
某种胃药中抗酸剂为CaCO3.甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应).请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源:2009-2010学年江苏省扬州市高二(上)期末化学试卷(必修)(解析版) 题型:解答题
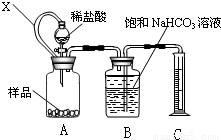
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com