
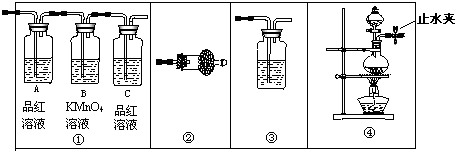
 如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )
如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )| A、二氧化锰和双氧水反应生成氧气 |
| B、浓氨水和生石灰混合生成氨气 |
| C、Na2SO3和浓H2SO4混合生成SO2 |
| D、锌粒与稀盐酸混合生成H2 |


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 产品标准 | GB5461 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H2>0 | ||||
B、一氧化碳的燃烧热△H=△H1-
| ||||
C、氢气的燃烧热△H=
| ||||
D、△H4=△H1-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液 | a | b | c | d | e | f | a |
| 溶质 | CH3COONa | NaHCO3 | NaClO | NaCN | C6H5ONa | Na2CO3 | CH3COONa |
| pH | 8.8 | 9.0 | 10.3 | 11.1 | 11.3 | 11.6 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4LN2含阿伏加德罗常数个氮分子 |
| B、在标准状况下,22.4L水的质量约为18g |
| C、22g二氧化碳与标准状况下11.2LHCl含有相同的分子数 |
| D、在同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n=x(3-0.5m) |
| B、m=n+2x |
| C、m=n-6,m、n均与x无关 |
| D、n=m,m、n均与x无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com