
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)2NH3(g)。
(1)若反应进行到某时刻t时,n(N2)=13 mol,n(NH3)=6 mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%,计算平衡时NH3的物质的量。
科目:高中化学 来源: 题型:
下列化学用语表示正确的是( )
A.H2O、Na2O的电子式都可用“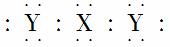 ”表示
”表示
B.Cl、Br、I的+1价含氧酸的结构式都可用“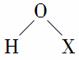 ”表示
”表示
C.乙酸、乙酸乙酯、葡萄糖的分子式都可用“CnH2nOn”表示
D.碳酸、亚硫酸的电离方程式都可用“H2XO32H++XO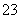 ”表示
”表示
查看答案和解析>>
科目:高中化学 来源: 题型:
4甲基2乙基1戊烯经催化加成所得产物名称为( )
A.4甲基2乙基戊烷 B.2,5二甲基戊烷
C.2乙基4甲基戊烷 D.2,4二甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
将等质量的两份锌粉a、b,分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
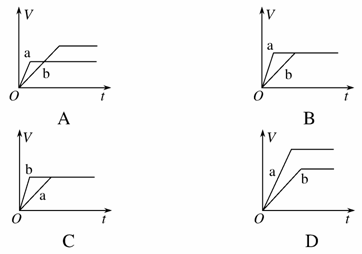
查看答案和解析>>
科目:高中化学 来源: 题型:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个电池。请填写下列空白:
(1)实验原理:Fe+2H+===Fe2++H2↑
(2)实验用品:电极(________、________)、稀硫酸、________、________、耳机(或者电流计)(填写所缺的实验用品)。
(3)实验装置如图。
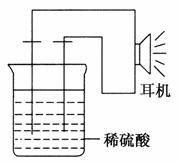
(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则________应该接电流计的负极,电极反应是________,发生了________反应;________应该接电流计的正极,电极反应是________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C(s)+CO2(g)2CO(g) ΔH>0。该反应达到平衡后,下列条件有利于反应向正反应方向进行的是( )
A.升高温度和减小压强
B.降低温度和减小压强
C.降低温度和增大压强
D.升高温度和增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g)H2O(g)+CO(g)的平衡常数K=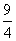 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)(mol·L-1) | 0.010 | 0.020 | 0.020 |
| c(CO2)(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.同周期元素中ⅦA族元素的相对原子质量最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.同周期中ⅠA族元素的金属性比ⅡA族元素的金属性强
D.所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是
A.NH4Br的电子式: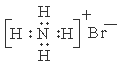 B.S原子的结构示意图:
B.S原子的结构示意图: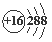
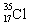 C.乙醇的结构简式:C2H6O D.原子核内有18个中子的氯原子:
C.乙醇的结构简式:C2H6O D.原子核内有18个中子的氯原子:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com