
| A. | 常温常压下,8g CH4含有4NA个氢原子 | |
| B. | 1mol Cu与足量FeCl3溶液反应,转移2NA个电子 | |
| C. | 1L0.1 mol•L-1(NH4)2SO4溶液中含有0.2NA个NH4+ | |
| D. | 10 L pH=l的硫酸溶液中含有的H+离子数为2NA |
分析 A.n=$\frac{m}{M}$计算物质的量,结合分子式计算氢原子数;
B.铜和足量氯化铁反应生成氯化铁和氯化铜,依据反应的铜金属电子转移;
C.硫酸铵溶液中,铵根离子部分水解,导致溶液中铵根离子数目减少;
D.pH=1的溶液中的氢离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢离子.
解答 解:A.8g甲烷的物质的量为:$\frac{8g}{16g/mol}$=0.5mol,甲烷分子中含有4个H原则,则0.5mol甲烷分子中含有氢原子的数目为:0.5mol×4×NA=2NA,故A错误;
B.铜和足量氯化铁反应生成氯化铁和氯化铜,1mol Cu与足量FeCl3溶液反应,转移2NA个电子,故B正确;
C.1L0.1 mol•L-1(NH4)2SO4溶液中含有溶质硫酸铵0.1mol,0.1mol硫酸铵溶液中含有0.2mol铵根离子,由于铵根离子部分水解,则溶液中含有的铵根离子小于0.2NA,故C错误;
D.pH=l的硫酸溶液中氢离子浓度为0.1mol,1L该溶液中含有0.1mol氢离子,含有的H+离子数为NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系为解答关键,试题知识点较多,充分考查学生的分析能力及灵活应用基础知识的能力.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:解答题

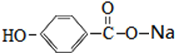 的化学试剂是NaHCO3(写化学式).
的化学试剂是NaHCO3(写化学式). ,E转化为F的化学反应类型是酯化反应或取代反应.
,E转化为F的化学反应类型是酯化反应或取代反应. +3NaOH$\stackrel{△}{→}$HOCH2CH2OH+NaCl+
+3NaOH$\stackrel{△}{→}$HOCH2CH2OH+NaCl+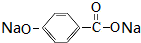 +H2O.
+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②中振荡后静置 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③加热 | 洗气瓶中溶液褪色 | 生成了乙烯 |
| D | ④通电 | A极上有红色固体析出 | 不能说明锌的金属性比铜强 |
| A. |  | B. | 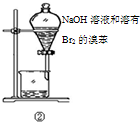 | C. | 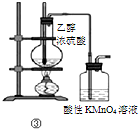 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,$\frac{{cCH}_{3}COOH}{{cH}^{+}}$变小 | |
| C. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-) | |
| D. |  向10.00 mL 0.1 mol•L-1HCOOH溶液中逐滴加入0.1 mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化),则c点NaOH溶液的体积小于10 mL 向10.00 mL 0.1 mol•L-1HCOOH溶液中逐滴加入0.1 mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化),则c点NaOH溶液的体积小于10 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )| A. | 滴定盐酸的曲线是图乙 | |
| B. | 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(X-) | |
| C. | 达到B、E状态时,反应消耗的,n(CH3COOH)>n(HCl) | |
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(X-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
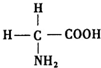 氨基酸是蛋白质的基石,甘氨酸是最简单的氨基酸(结构如图),在甘氨酸分子中,N原子的杂化形式是sp3,在甘氨酸分子中C、N、O原子的第一电离能从大到小的顺序是N>O>C;氮可以形成多种离子,如N3-、NH2-、NH4+、N2H5+等,其中,NH4+的空间构型是正四面体.
氨基酸是蛋白质的基石,甘氨酸是最简单的氨基酸(结构如图),在甘氨酸分子中,N原子的杂化形式是sp3,在甘氨酸分子中C、N、O原子的第一电离能从大到小的顺序是N>O>C;氮可以形成多种离子,如N3-、NH2-、NH4+、N2H5+等,其中,NH4+的空间构型是正四面体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 将氯化铁饱和溶液煮沸,以制取氢氧化铁胶体 | |
| C. | 某无色溶液中加入足量稀盐酸无明显现象,再滴加BaCl2溶液有白色沉淀生成,则原溶液中一定含有SO42- | |
| D. | 用无锈铁丝蘸取某溶液在酒精灯上灼烧,火焰呈黄色,则说明该溶液中一定不含钾离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5mL0.02mol/L的H2SO4溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2 | |
| B. | 将0.2mol/L的某一元酸HA溶液和0.1mol/LNaOH溶液等体积混合,混合液pH大于7,则反应后的混合液中:c(OH-)+c(A-)>c(H+)+c(HA) | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | 常温下,0.1mol/L的CH3COONa和NaClO的混合溶液中:c(OH-)-c(H+)=c(HClO)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
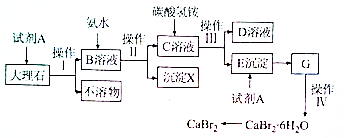
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com