
��8�֣�ˮú�������Ǻϳɰ���ԭ����Ҳ�Ǻϳ������仯����Ʒ��ԭ�ϡ�
��1��ֱ��ˮú��ȼ�ϵ���У�ͨCO��H2�ļ�Ϊ��ص� ����ѡ�������������������
��2��ˮú���任��Ӧ��CO(g) + H2O(g)  CO2(g) + H2(g) ��H �� 0�����д�ʩ����߷�Ӧ���ʵ��� ��������ѡ��
CO2(g) + H2(g) ��H �� 0�����д�ʩ����߷�Ӧ���ʵ��� ��������ѡ��
a.�����¶� b.������� c.����ѹǿ d.����Ũ��
��3��H2��N2�ڴ��������¸�ѹ�����ºϳɰ��Ļ�ѧ����ʽΪ ��
��4��������ˮ��Һ�����������̵����еĶ������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��5������״����582.4L�ϳ�������֪��n(CO)��n(H2)=4��9��ͨ��ϳ�����һ�������¿ɷ���2CO(g)+ 4H2(g) �� CH2=CH2(g)+2H2O(g)��CO(g)+3H2��CH4(g)+H2O(g)����ַ�Ӧ���ⶨ��Ʒ��ֻ�м��顢��ϩ��ˮ�������ٶ�CO��H2����ʣ�ࣩ���Լ����ݳ�����������ϩ�����ʵ������г�������̣���
��1���� ��2��abc ��3��N2 + 3H2 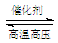 2NH3
2NH3
��4��SO2 + 2NH3 +H2O = (NH4)2SO3 [��SO2 + NH3 +H2O = NH4HSO3]
��5���������⣺n(CO) +n(H2)=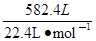 =26mol
=26mol
n(CO)=26mol��4/(4+9)=8mol,n(H2)=26mol��8mol=18mol
�ɷ���ʽ��2CO(g)+ 4H2(g)��C2H4(g)+2H2O(g)��CO(g)+ 3H2(g) �� CH4(g)+ H2O(g)
n(CH4)+2n(C2H4)="8mol" , 3n(CH4)+4n(C2H4)=18mol�����n(C2H4)=3mol��
�����������������ˮú��ȼ�ϵ���У���ԭ��CO��H2����صĸ�����
��ͨ�����¡���ѹ������Ũ�ȡ�����������ܼӿ췴Ӧ���ʣ�
��H2��N2�ڴ��������¸�ѹ�����»��ϳɰ���N2 + 3H2 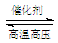 2NH3��ע��÷�ӦΪ���淴Ӧ����
2NH3��ע��÷�ӦΪ���淴Ӧ����
�Ȱ�����ˮ��Һ���ն���������ܲ���(NH4)2SO3��NH4HSO3��
������ο��𰸡�
���㣺����ԭ��ء���Ӧ���ʵ�Ӱ�����ء���ѧ����ʽ����д�뻯ѧ���㡣


 ��ѧ��ʦ����ϵ�д�
��ѧ��ʦ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ�ܱ������г���1mol N2��3mol H2����һ�������·�����ӦN2��3H2 2NH3,�����й�˵����ȷ���ǣ� ��
2NH3,�����й�˵����ȷ���ǣ� ��
| A���ﵽ��ѧƽ��ʱ������Ӧ���淴Ӧ�����ʶ�Ϊ�� |
| B��������3u��(N2)��u��(H2)ʱ����Ӧ�ﵽƽ��״̬ |
| C���ﵽ��ѧƽ��ʱ����λʱ������amolN2��ͬʱ����3amolH2 |
| D����N2��H2��NH3�ķ�������Ϊ1��3��2����Ӧ�ﵽƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���á���ѧ����ת�Ʒ����Ʊ�TaS2���壬ij�¶��µ�2L�����ܱ������м���һ���� �� I2��g����TaS2��s���������·�Ӧ
TaS2��s��+2I2��g�� TaI4��g��+S2��g����H��a kJ��mol-1 ��I��
TaI4��g��+S2��g����H��a kJ��mol-1 ��I��
��ƽ��ʱ��TaS2��s����I2��g����TaI4��g������S2��g�������ʵ����ֱ�Ϊ3 mol ��2mol��2mol��2mol��
��1����Ӧ��I����ƽ�ⳣ������ʽK=
��2�������¶��¸�������ijʱ��TaS2��s����I2��g����TaI4��g������S2��g�������ʵ����ֱ�Ϊ2mol��2mol��4mol��4mol�����ʱ��ƽ���� �������Ӧ�����淴Ӧ�����ƶ���v�� v�棨���������������������
��3���ڲ�ͬ�¶��£��÷�Ӧ��ƽ�ⳣ��K���±���
| �¶�/�� | 40 | 80 | 200 |
| ƽ�ⳣ��K | 1 | 1.5 | 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��12 �֣�T��ʱ����ij�ݻ���Ϊ2L�ܱ������г���2molN2��4molH2���ڴ��������·�����Ӧ��N2(g)+3H2(g) 2NH3(g) ��H=��92.0kJ /mol��t0ʱ�̣�����ƽ��������NH3����Ϊ2mol����t1ʱ�̿�ʼ���ı䷴Ӧ��һ����������ϵ�з�Ӧ������ʱ��仯�����������ͼ��ʾ��
2NH3(g) ��H=��92.0kJ /mol��t0ʱ�̣�����ƽ��������NH3����Ϊ2mol����t1ʱ�̿�ʼ���ı䷴Ӧ��һ����������ϵ�з�Ӧ������ʱ��仯�����������ͼ��ʾ��
�Իش��������⣺
��1��T��ʱ��N2��ת����Ϊ��___________���÷�Ӧ��ƽ�ⳣ��K=___________��
��2��T��ʱ��������֤���÷�Ӧ�Ѿ�����ƽ��״̬���ǣ�__________________��
| A����ϵ��ѹǿ���ٸı� |
| B�����������ɫ���ٸı� |
| C��H2�������ٷֺ������ٸı� |
| D��c(N2)��c(NH3)�ı�ֵ���ٸı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����4�֣���һ���̶����Ϊ2�����ܱ������У�����2molA��1molB�� �� �����·�Ӧ�� 2A��g��+B��g�� 3C��g��+D��s����2���ӷ�Ӧ�ﵽƽ�⣬��ʱC��Ũ��Ϊ1��2 mol/L��
3C��g��+D��s����2���ӷ�Ӧ�ﵽƽ�⣬��ʱC��Ũ��Ϊ1��2 mol/L��
��1��2��������B��ʾ��ƽ����Ӧ�ٶ�Ϊ ��
��2���������¶����ߣ�ƽ��ʱ��������ƽ�����Ħ��������С��������ӦΪ�� ������ȡ����ȡ�����Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
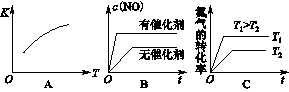
����β���ﺬ�е�NO������������ȼ��ȼ�յĸ�����������������Ӧ���£� N2(g)��O2(g)? 2NO(g)����H>0����֪�÷�Ӧ��2 404 �� ʱ��ƽ�ⳣ��K��64��10��4����ش�
2NO(g)����H>0����֪�÷�Ӧ��2 404 �� ʱ��ƽ�ⳣ��K��64��10��4����ش�
��1��ij�¶��£���2L���ܱ������г���N2��O2��1mol��5���Ӻ�O2�����ʵ���Ϊ0.5mol����N2�ķ�Ӧ����________��
��2���ٶ��÷�Ӧ���ں��������½��У��жϸ÷�Ӧ�ﵽƽ��ı�־________��
| A������1 mol N2ͬʱ����1 mol O2 | B����������ܶȲ��� |
| C���������ƽ����Է����������� | D��2v(N2)����v(NO)�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ͼ����ʾʵ��װ��֤������ͭ�ܼӿ�Լ7%��˫��ˮ�ķֽⲢ��������̵Ĵ�Ч�����бȽ�(���ȽϷ�Ӧ����)����ͼʾװ�ò�������������������������Ӱ��ʵ������ؾ��Ѻ��ԣ�����������£�
��1����ʵ��ԭ��������ʵ���еġ��������ݡ�����ָ��Ҳ����ָ ��
��2��ʵ��ʱ�����ռ���B�У�B����������__________����Ҫ���������������O2���������ռ����� ���õ��ɼм�סB�¶��齺�ܣ�������Ƥ���� ��
��3��Ϊ̽��CuO��ʵ������Ƿ�������ã�����ٱȽ��⣬���貹������ʵ�鲻��д���岽��)��a��֤��CuO�Ļ�ѧ����û�б仯��b�� ��
��4��Ϊ֤������ͭ�Ļ�ѧ�����ڼ���˫��ˮǰ��û�з����ı䣬�������֤��ʵ���� ��
��5��ʵ�鿪ʼʱ,���������м���һ������˫��ˮ��,���ڶ�ʱ���ڲ�����������,��Һ©���ڵ�Һ�岻��˳������,Ϊ�˽���������,���ȡ�Ĵ�ʩ�� ;�ڲ������ɵ��������ʱ,����Ҫע�������밼Һ����ƽ����,��Ӧע��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(12��).
��1.0 L�ܱ������з���0.10molA(g)����һ���¶Ƚ������·�Ӧ:
A(g) B(g)��C(g) ��H=+85.1kJ��mol��1�����ȷ�Ӧ��
B(g)��C(g) ��H=+85.1kJ��mol��1�����ȷ�Ӧ��
��Ӧʱ��(t)��������������ѹǿ(p)�����ݼ��±���
| ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| ��ѹǿp/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| ��Ӧʱ��t/h | 0 | 4 | 8 | 16 |
| C��A��/��mol��L-1�� | 0.10 | a | 0.026 | 0.0065 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(17��)���������������������ͻ�ѧ���ԣ��Ǹ�����ҵ����Ҫԭ�ϡ�
��1���ʻ����ᴿ���漰�ķ�ӦΪ��Ni��s��+4CO��g�� Ni��CO��4��g��
Ni��CO��4��g��
�ٵ��¶�����ʱ��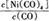 ��С����?H 0���>����<������
������?H 0���>����<������
��һ���¶��£���һ�����Ĵ�����CO����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����________������ţ���
������ͬ�¶��£�������Ӧ�������Ϊ1L�ĺ����ܱ������н��У�ƽ�ⳣ�� ������������䡱��С��������Ӧ����3s����Ni(CO)4�����ʵ���Ϊ0��6mol����0��3s�ڵ�ƽ����Ӧ����v(CO)=____mol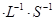 ��
��
��Ҫ���������Ӧ��CO��ת���ʣ�ͬʱ����Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩΪ____________________��д��һ����ʩ���ɣ���
��2����NiS04��ҺΪ�������Һ���д�������Fe��Zn��Cu��Pt��Au�����ʣ��ĵ�⾫��������˵����ȷ����____________������ţ���(��֪�����ԣ�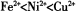 )
)
a���������У���ѧ��ת��Ϊ����
b��������������������ԭ��Ӧ
c������������ɻ���Cu��Pt��Au�Ƚ���
d����������ʱͨ���ĵ���������������������������
��3����ҵ��������(NiS)��Ϊ�缫����ұ���������ʱ�������е���Ԫ���Ե�����̬������ij�缫��������Ԫ����Ni2����̬������Һ�У���ͼ��ʾ���������Դ��____________�������������������ӡ�д�������ĵ缫��Ӧʽ________________��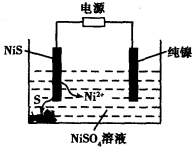
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com