
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A. | 达平衡后升温,反应速率增大,压强减小 | |
| B. | 其他条件不变,增加压强能提高CO的转化率 | |
| C. | 该反应△H>0 | |
| D. | 830℃时,在2 L的密闭容器中加入4 mol CO(g)和4 mol H2O(g),平衡时,CO的转化率是50% |
分析 A.升高温度,反应速大,由pV=nRT可知,n、V不变,压强与温度成正比;
B.该反应为气体体积不变的反应,增大压强,平衡不移动;
C.由表格数据可知,温度越高,K越小,则升高温度,平衡逆向移动;
D.830℃时,K=1.0,设转化的CO为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 2 2 0 0
转化 x x x x
平衡 2-x 2-x x x
可知$\frac{x×x}{(2-x)(2-x)}$=1.0,以此来解答.
解答 解:A.升高温度,反应速大,由pV=nRT可知,n、V不变,压强与温度成正比,则压强增大,故A错误;
B.该反应为气体体积不变的反应,增大压强,平衡不移动,则CO的转化率不变,故B错误;
C.由表格数据可知,温度越高,K越小,则升高温度,平衡逆向移动,则该反应为放热反应,△H<0,故C错误;
D.830℃时,K=1.0,设转化的CO为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 2 2 0 0
转化 x x x x
平衡 2-x 2-x x x
可知$\frac{x×x}{(2-x)(2-x)}$=1.0,解得x=1,CO的转化率是50%,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握K与温度的关系、平衡三段法、平衡移动为解答的关键,侧重分析与计算能力的考查,注意结合平衡浓度计算K,题目难度不大.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 加热胆矾失去结晶水,得到白色无水硫酸铜,这一过程叫风化 | |
| B. | 家用石碱(主要成分是Na2CO3•10H2O )久置后,由块状变成粉末状,这一变化是风化的结果 | |
| C. | 含有水蒸气的气体通过固体NaOH 时,固体表面出现水珠,这是固体氢氧化钠潮解的原故 | |
| D. | 从冰箱取出物品,表面很快出现水珠,这种现象叫潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | 二氧化硫有漂白性,大量用作棉,麻、纸张和食品的漂白 | |
| C. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| D. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)$?_{催化剂}^{500℃、30M}$2NH3(g)?△H=-38.6 kJ•mol-1 | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
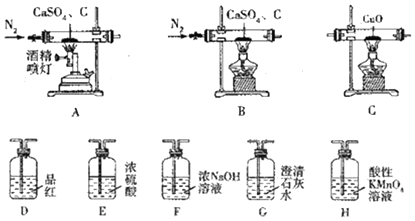
| 实验前 | 实验后 | |
| 实验1 | 装置C硬质玻璃管连同CuO质量为26.80g | 装置C硬质玻璃管连同反应后固体质量为26.64g |
| 实验2 | 装置G连同溶液质量为187.50g | 装置G连同反应后溶液及沉淀的质量为188.38g |
| 实验3 | 装置D、H连同溶液质量和为373.60g | 装置D、H连同溶液质量和为374.24g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
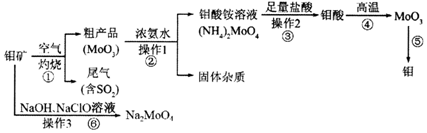
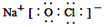 ;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O
;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 | B. | Fe2O3、SiO2 | C. | SiO2、Al2O3 | D. | Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
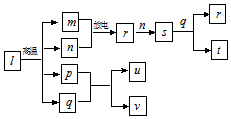 短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0,.01mol•L-1 v溶液的pH均为2.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0,.01mol•L-1 v溶液的pH均为2.下列说法不正确的是( )| A. | 原子半径:r(X)<r(Z)<r(Y) | |
| B. | 简单氢化物的稳定性:Z>W>Y | |
| C. | 上述转化关系中的物质的类别有单质、酸及酸性氧化物等 | |
| D. | X、Y、Z三种元素形成的化合物中可能含有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com