
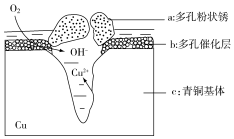
 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极c被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145 g Cu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O═4OH- |
分析 A、根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极被氧化;
B、Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀;
C、n[Cu2(OH)3Cl]=$\frac{2.145g}{214.5g/mol}$=0.01mol,根据转移电子计算氧气物质的量,再根据V=nVm计算体积;
D、氧气得电子生成氢氧根离子;
解答 解:A、根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极被氧化,腐蚀过程中,负极是c,故A正确;
B、Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,故B正确;
C、n[Cu2(OH)3Cl]=$\frac{2.145g}{214.5g/mol}$=0.01mol,根据转移电子得n(O2)=$\frac{0.01×2×2}{4}$=0.01mol,消耗标准状况氧气体积为 0.224 L,故C错误;
D、氧气在正极得电子生成氢氧根离子,电极反应式为:O2+4e-+2H2O=4OH-,故D正确;
故选:C.
点评 本题考查了原电池原理及电极反应式、电池反应式的书写及其计算,难度中等,掌握原理是解题关键.


科目:高中化学 来源: 题型:选择题
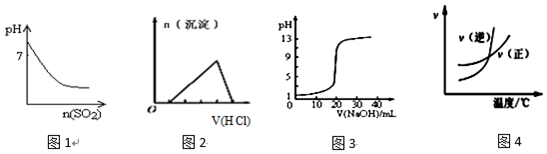
| A. | 图1表示将SO2气体通入溴水中,所得溶液的pH变化 | |
| B. | 图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀的物质的量与盐酸体积的关系 | |
| C. | 图3表示常温下,向0.1000mol•L-1HCl溶液中滴加20.00mL 0.1000mol•L-1氨水的滴定曲线 | |
| D. | 图4表示乙醇的催化氧化反应中速率随温度的变化图象,升高温度该反应的平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量氨水,有白色沉淀生成,则原溶液中一定有Al3+ | |
| B. | 加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42- | |
| C. | 向某溶液中先加入氯水振荡,再加KSCN溶液后显血红色,该溶液中一定有Fe2+ | |
| D. | 向某溶液中先加入新制饱和氯水,再加CCl4,振荡,分层,下层呈橙红色,则该溶液中一定含有Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X和Y都是性质活泼的元素,在自然界中只能以化合态存在 | |
| B. | X和Y形成的化合物的化学式可能为Y2X2 | |
| C. | X的化合物种类比Y的化合物种类少 | |
| D. | Y能置换酸中氢放出氢气,但不能置换盐中的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| m | n | ||
| x | y |
 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
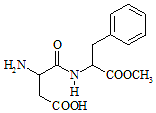 阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )
阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )| A. | 分子式为C14H18N2O3,阿斯巴甜不属于蛋白质 | |
| B. | 阿斯巴甜的水解产物中只有一种氨基酸 | |
| C. | 阿斯巴甜在一定条件下不能与酸反应、只能与碱反应 | |
| D. | 阿斯巴甜分子中有3个手性碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com