
在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质中,下列说法正确的
A.Mg(OH)2的溶解度最小 B.Ca(OH)2的溶解度最小
C.AgCl的溶解度最小 D.同下Ksp越大的溶解度也越大
科目:高中化学 来源:2013-2014学年江西省赣州市六校高三上学期期末联考理综化学试卷(解析版) 题型:选择题
纯碱(Na2CO3) 在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图:
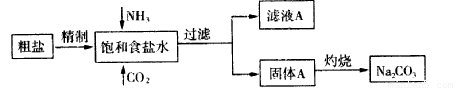
已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl。请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。
精制除杂的步骤顺序a→_______→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣;
b.加入盐酸调pH;
c.加入Ba(OH) 2溶液;
d.加入Na2CO3溶液;
e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是_____________________。
(2)灼烧固体A制Na2CO3应在_____(填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是 。对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3,使pH降低,反应的离子方程式______________________。
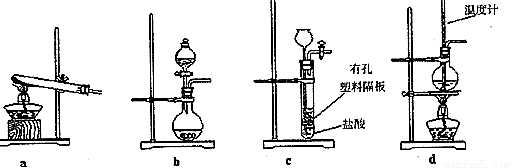
(3)下图装置中常用于实验室制备CO2的是_____(填字母编号);用b示意的装置制备NH3时,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂 (填试剂名称)。
(4)一种天然碱晶体成分是aNa2CO3·bNa2SO4·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实验方案。请把实验方案补充完整(仪器自选):
供选择的试剂:1.0 mol·L-1H2SO4溶液、1.0 mol·L-1BaCl2溶液、稀氨水、碱石灰、Ca(OH) 2溶液、蒸馏水
①称取m1 g一定量天然碱晶体样品,溶于适量蒸馏水中;
②_________________________________________________________________;
③_________________________________________________________________;
④计算天然碱晶体中含Na2CO3的质量分数。
查看答案和解析>>
科目:高中化学 来源:2015届云南省高一下学期期中考试化学试卷(解析版) 题型:填空题
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2) H2O以 键结合(填极性键、非极性键、离子键)
(3)在pH=1的溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(4)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
A.Cl2+H2O=HCl+HClO B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑ D.3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(5)已知KH和H2O反应生成H2和KOH,反应中1mol KH (填失去,得到) mol电子
(6)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修2 1.2硬水软化练习卷(解析版) 题型:填空题
某自来水中含有Ca2+、Mg2+、Na+、K+、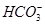 、
、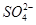 、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉、引起爆炸的危险,因此要定期清除锅炉水垢。已知部分物质20 ℃时的溶解度数据为
、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉、引起爆炸的危险,因此要定期清除锅炉水垢。已知部分物质20 ℃时的溶解度数据为
|
物质 |
Mg(OH)2 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
CaSO4 |
MgSO4 |
|
溶解度 g/100 g H2O |
9.0×10-4 |
1.5×10-3 |
1.0×10-2 |
1.7×10-1 |
2.1×10-1 |
26.7 |
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:
________________________________________________________________________
________________________________________________________________________。
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是____________。(填序号)
A.NaOH B.NaHCO3
C.Na2CO3 D.NaCl
CaSO4能转化为物质Y的原因是(用文字叙述)_______________________________________
________________________________________________________________________。
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)_________________ _______________________________________________________。
(4)若所用自来水的硬度为33.6度(计算硬度是将Ca2+、Mg2+都看成Ca2+,并将其折算成相当于CaO的质量,通常1 L水中含有10 mg CaO称为1度)。1 t这样的水中相当于含CaO的物质的量为__________(水的密度为1 g/cm3)。
(5)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应。现取含Ca2+浓度为0.40 g/L的自来水样10 mL至锥形瓶中进行滴定,达到滴定终点时,用去了浓度为0.01 mol/L的M溶液20.00 mL,则该自来水样中Mg2+的物质的量浓度是____________。
查看答案和解析>>
科目:高中化学 来源:2014届广东省高二上学期期末考试理科化学试卷(解析版) 题型:填空题
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)FeO42-与水反应的方程式为:4FeO42- + 10H2O  4Fe(OH)3 + 8OH-+ 3O2,
4Fe(OH)3 + 8OH-+ 3O2,
K2FeO4在处理水的过程中所起的作用是 和 。
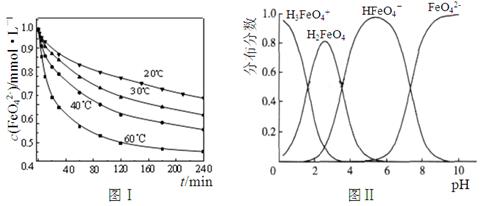
(2)将适量K2FeO4配制成c(FeO42-) =1.0×10-3 mol·L-1(1.0mmol·L-1)的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。题(1)中的反应为FeO42-变化的主反应,该反应的△H 0。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4- H++FeO42-的电离平衡常数表达式为K=___________________,其数值接近 (填字母)。
H++FeO42-的电离平衡常数表达式为K=___________________,其数值接近 (填字母)。
A.10-2.5 B.10-6 C.10-7 D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL,1.0×10-3 mol·L-1的K2FeO4溶液中的c(FeO42- )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量为 mol,
完全沉淀后溶液中残留的c(FeO42- )为______________。
查看答案和解析>>
科目:高中化学 来源:浙江省2010-2011学年高三第一次质量检测 题型:填空题
常温下Ca(OH)2的Ksp=5.5×10-6,KspAg2SO4= 1.2 ×10-5,KspAgCl=1.56×10-10 ,现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+阴离子有Cl-、OH-、HCO3-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
① 测得溶液A、C、E呈碱性,且碱性为A>E>C;
② 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③ 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
④ 在D溶液中滴加BaCl2溶液未看到白色沉淀
根据上述实验现象,回答下列问题:
(1)写出下列化合物的化学式:A C D E
(2)写出③中白色絮状沉淀变成红褐色过程中发生的化学反应方程式
(3)小骐同学欲将B、F混合,不小心将B、F倒入了稀盐酸中,马上看到有白色沉淀,你认为此白色沉淀中一定有 ,该同学还可以看到另一个现象,用离子方程式解释产生原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com