
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是
A.2C+SiO2![]() 2CO↑十Si,则每生成4.48 L CO时转移电子0.4NA
2CO↑十Si,则每生成4.48 L CO时转移电子0.4NA
B.1 mol NH3完全溶于水,则n(NH3·H2O)+n(NH4+)=l mol
C.氯化铝在气态时以双聚分子存在,其球棍模型为![]() ,则1 mol双聚分子中含有电子数为128NA
,则1 mol双聚分子中含有电子数为128NA
D.2SO2(g)+O2(g)2SO3(l) △H=-a kJ·mol-1(a>0),则每生成2 mol SO3(l)时吸热a kJ
【答案】C
【解析】
A. 2C+SiO2![]() 2CO↑+Si,无标准状况,不能求出4.48L CO的物质的量,A错误;
2CO↑+Si,无标准状况,不能求出4.48L CO的物质的量,A错误;
B. 1 mol NH3完全溶于水,含N的微粒有NH3·H2O、NH4+、NH3,根据物料守恒,n(NH3·H2O)+n(NH4+)+n(NH3)=l mol,B错误;
C. 氯化铝在气态时以双聚分子存在,其球棍模型为![]() ,则1mol双聚分子中含有2NA个Al,6NA个Cl,电子数为13×2NA+17×6NA=128 NA,C正确;
,则1mol双聚分子中含有2NA个Al,6NA个Cl,电子数为13×2NA+17×6NA=128 NA,C正确;
D. 2SO2(g)+O2(g)2SO3(l)△H=-a kJ·mol-1(a>0),是放热反应,每生成2mol SO3(l)时放热a kJ,D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】中国不少古诗词清晰描述了当时人们的生活和社会的发展,如刘禹锡的《浪淘沙》“日照澄洲江雾开,淘金女伴满江隈,美人首饰侯王印,尽是沙中浪底来。”下列有关本诗中蕴含的化学知识认知正确的是
A.雾的分散质粒子直径范围是1~100nmB.淘金原理与化学上的萃取一致
C.沙子的主要成分是![]() D.“沙中浪底来”指的是金的氧化物
D.“沙中浪底来”指的是金的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属的冶炼方法有很多,有加热法,热还原法、 电解法、湿法冶金等:我国古代利用铁和硫酸铜溶液反应炼铜,属于___(填冶炼的方法);铝热反应是铝与一些金属氧化物在高温下反应,属于___(填冶炼的方法);写出铝与四氧化三铁的反应方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】层状复合金属氢氧化物(简称“层状氢氧化物”),主体层板由二元(或多元)金属氢氧化物层构成,层间阴离子可以被其他阴离子取代,因此可以作为离子交换剂,在材料、化工、医药和环境保护等方面有着广泛的用途。镁铝碳酸根型水滑石是人们最早发现的层状氢氧化物。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最小的是___________(填标号)。
A. B.
B. C.
C.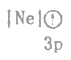 D.
D.
(2)一种水滑石的化学式为Mg4Al2(OH)12CO3H2O.其层板结构如图1。CO32-中碳的杂化类型是____。在图中最小的一个二维菱形晶胞(以图中Al为顶点)中含有___________个Al3+。每个镁氧八面体周围有_______________个相邻铝氧八面体和_______________个相邻镁氧八面体。
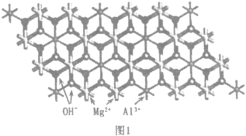
(3)水滑石中氢氧化物层的OH-和层间阴离子间的主要作用力为_______________,水滑石作为离子交换剂,去除水体中阴离子去除效果依次为:PO43->CrO42->NO3-,其原因是___________
(4)当加热到一定温度时,水滑石类化合物会发生分解,部分产物转化为尖晶石结构的MgxAlyOz,晶体结构如图2所示,它的化学式为___________;A块、B块均为边长为apm的立方体,设阿伏加德罗常数为NA,则最近的两个Al离子之间的距离为___________pm,密度为___________gcm-3(列出计算表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 ,下列说法正确的是
,下列说法正确的是
A.该物质可由两种单体分子之间通过加聚反应生成
B.该物质的有机物单体,不能使FeCl3溶液显紫色
C.0.1 mol单体(有机物)与足量Na反应,生成2.24 L H2(标准状况)
D.1 mol该物质与足量NaOH溶液反应,最多可消耗2n mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了讲授“氯气的性质和用途”,一老师以二氧化锰和浓盐酸为主要原料制取氯气,并设计了如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行教学。
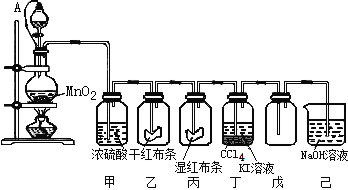
试回答下列问题:
(1)乙和丙中的现象分别是 ____________________、____________________;由上述现象可得出结论:_____________________(写化学式)具有漂白作用;
(2)分离丁中液体的方法是 _______;
(3)圆底烧瓶内发生反应的化学方程式为__________________________________;
(4)分液漏斗与烧瓶连接橡皮管的目的是 __________________________________;
(5)己烧杯中反应的离子方程式为:________________________________________;
(6)将产生的Cl2通入FeCl2溶液中得到含有FeCl2和FeCl3的混合物,实验测得混合物中n(Fe元素)∶n(Cl元素)=1:2.4,则该溶液中Fe2+和Fe3+的物质的量浓度之比约为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是( )

A. 根据图甲(S表示溶解度)表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B
B. 图乙表示25℃时,用0.1mol ·L-1盐酸滴定20mL 0.1mol ·L-1NaOH溶液的pH随加入酸体积的变化
C. 根据图丙表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 根据图丁可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.2-丁烯不存在顺反异构体
B.已知丙烷的二氯代物有四种异构体,则其六氯代物的异构体数目为六种
C.菲的结构简式为 ,它与硝酸反应,可生成4种一硝基取代物
,它与硝酸反应,可生成4种一硝基取代物
D.乙醛的核磁共振氢谱中有二个峰,峰面积之比是1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T0℃时,在2 L的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
图a 图b
图b
A.该反应的正反应是吸热反应
B.T1℃时,若该反应的平衡常数K =50,则T1<T0
C.图a中反应达到平衡时,Y的转化率为37.5%
D.T0℃,从反应开始到平衡时:v(X)=0.083 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com