
| A. | 1 mol H2 | B. | 0.5 mol NH3 | ||
| C. | 6.02×1023个的CH4分子 | D. | 0.3 mol H3PO4 |
分析 根据N=nNA可知,物质分子中含有氢原子的物质的量越大,则含有氢原子的数目越多,先分别计算出各选项中含有氢原子的物质的量,然后进行比较即可.
解答 解:根据N=nNA可知,物质分子中含有氢原子的物质的量越大,则含有氢原子的数目越多,
A.1 mol H2分子中含有2molH原子;
B.0.5 mol NH3分子中含有H原子的物质的量为:0.5mol×3=1.5mol;
C.6.02×1023个的CH4分子的物质的量为:$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1mol,1mol甲烷分子中含有4molH原子;
D.0.3molmol H3PO4中含有H原子的物质的量为:0.3mol×4=1.2mol;
根据分析可知,含有H原子物质的量最大的为C,则C中含有H原子数最多,
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 白磷和三硫化二锑 | B. | 红磷和三硫化二锑 | ||
| C. | 氯酸钾、二氧化锰和硫 | D. | 硝酸钾、二氧化锰和硫等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
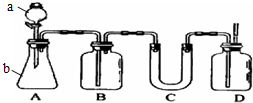 如图A是实验室用石灰石和稀盐酸制取CO2的常用装置.请选用适当的化学试剂和实验用品,用图中的D装置收集一瓶干燥、纯净的CO2气体.
如图A是实验室用石灰石和稀盐酸制取CO2的常用装置.请选用适当的化学试剂和实验用品,用图中的D装置收集一瓶干燥、纯净的CO2气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
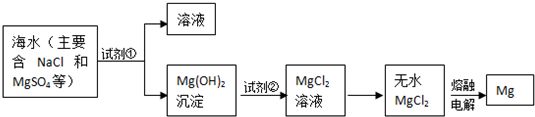
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 项目 | 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4(催化剂) 100℃~125℃ | PdCl2~CuCl2(催化剂) 100℃~125℃ |
| 平衡转化率 | 乙炔转化率 90% | 乙烯转化率 80% |
| 反应速率 | 较 慢 | 较 快 |
| 原料来源生产工艺 | CaCO3$\stackrel{高温}{→}$CaO$\stackrel{+C电炉}{→}$ CaC2$\stackrel{饱和食盐水}{→}$C2H2 | 石油裂解气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和Na2S溶液 | B. | 饱和NaHCO3溶液 | C. | 饱和NaHS溶液 | D. | 饱和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| B. | 甲醛能发生氧化反应、还原反应和聚合反应 | |
| C. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| D. | 聚合物(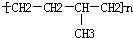 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
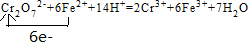 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com