
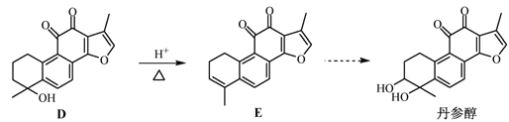
【题目】丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下:
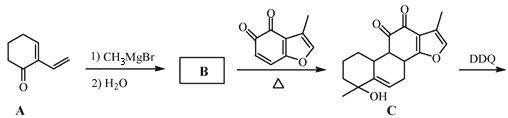
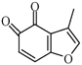
已知:① ②
②![]()
(1)A中的官能团名称为羰基和_______________。
(2)D![]() E的反应类型为__________反应。
E的反应类型为__________反应。
(3)B的分子式为C9H14O,则B的结构简式为_______________。
(4) 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______________。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______________。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应;
③核磁共振氢谱中有4个吸收峰,峰面积比为1:1:2:2。
(5)请补全以![]() 和
和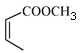 为原料制备
为原料制备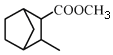 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
![]() 中间产物①__________
中间产物①__________![]() 中间产物②__________
中间产物②__________![]() 中间产物③__________反应物④ _______反应条件⑤__________
中间产物③__________反应物④ _______反应条件⑤__________![]()
【答案】碳碳双键 消去 
 或
或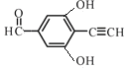
![]()
 H2 催化剂、加热
H2 催化剂、加热
【解析】
根据第(3)习题知,B的分子式为C9H14O,B发生信息①的反应生成C,则B为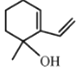 ;C中去掉氢原子生成D,D发生消去反应生成E,醇羟基变为碳碳双键,E发生一系列反应是丹参醇,据此分析解答(1)~(4);
;C中去掉氢原子生成D,D发生消去反应生成E,醇羟基变为碳碳双键,E发生一系列反应是丹参醇,据此分析解答(1)~(4);
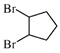
(5)![]() 和溴发生加成反应生成
和溴发生加成反应生成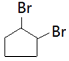 ,
, 发生消去反应生成
发生消去反应生成![]() ,
,![]() 和
和![]() 发生加成反应生成
发生加成反应生成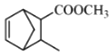 ,
, 和氢气发生加成反应生成
和氢气发生加成反应生成![]() ,据此分析解答。
,据此分析解答。
(1)A(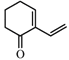 )的官能团有碳碳双键和羰基,故答案为:碳碳双键;
)的官能团有碳碳双键和羰基,故答案为:碳碳双键;
(2)通过流程图知,D中的醇羟基转化为E中的碳碳双键,所以D→E的反应类为消去反应,故答案为:消去反应;
(3)通过以上分析知,B的结构简式为 ,故答案为:
,故答案为: ;
;
(4)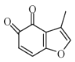 的分子式为C9H6O3,不饱和度为
的分子式为C9H6O3,不饱和度为![]() =7,一种同分异构体同时满足下列条件:①分子中含有苯环,能与FeCl3溶液发生显色反应,说明含有酚羟基;②能发生银镜反应;能发生银镜反应,说明含有醛基;苯环的不饱和度为4,醛基为1,因此分子中还含有1个碳碳三键;③核磁共振氢谱中有4个吸收峰,峰面积比为1∶1∶2∶2。符合条件的结构简式为
=7,一种同分异构体同时满足下列条件:①分子中含有苯环,能与FeCl3溶液发生显色反应,说明含有酚羟基;②能发生银镜反应;能发生银镜反应,说明含有醛基;苯环的不饱和度为4,醛基为1,因此分子中还含有1个碳碳三键;③核磁共振氢谱中有4个吸收峰,峰面积比为1∶1∶2∶2。符合条件的结构简式为 或
或 ,故答案为:
,故答案为: 或
或 ;
;
(5)![]() 和溴发生加成反应生成
和溴发生加成反应生成 ,
, 发生消去反应生成
发生消去反应生成![]() ,
,![]() 和
和![]() 发生加成反应生成
发生加成反应生成 ,
, 和氢气发生加成反应生成
和氢气发生加成反应生成![]() ,即中间产物①为
,即中间产物①为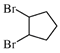 ,中间产物②为
,中间产物②为![]() ,中间产物③为
,中间产物③为 ,反应物④为H2,反应条件⑤为催化剂、加热,故答案为:
,反应物④为H2,反应条件⑤为催化剂、加热,故答案为: ;
;![]() ;
; ;H2;催化剂、加热。
;H2;催化剂、加热。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
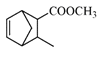
【题目】扁桃酸衍生物是重要的医药中间体,以物质a为原料合成扁桃酸衍生物b的过程如下:下列说法正确的是( )

A.物质X是Br2, 物质a转化为b属于取代反应
B.lmol物质a能与3molH2反应,且能在浓硫酸中发生消去反应
C.物质b具有多种能与NaHCO3反应的同分异构体
D.物质b的核磁共振氢谱有四组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能证明甲酸(HCOOH,一元酸)为弱酸的是( )
A.0.1mol/L甲酸的pH为2.3
B.将pH=2的甲酸稀释100倍后,溶液的pH小于4
C.温度升高,溶液的导电能力增强
D.等体积等浓度的甲酸和HCl与足量的锌反应,产生等量的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是网络表情包“苯宝宝装纯(醇)”,该分子由“苯宝宝”与羟基相连,下列说法正确的是
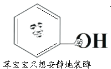
A.该分子属于醇B.该分子中含有两种含氧官能团
C.该物质在空气中放置一段时间会变为粉红色D.该分子苯环上的一个氢原子被丙基(-C3H7)取代所得的同分异构体最多有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA、利用反应2MgO+Si![]() 2Mg↑+SiO2获取镁,每生成1mol Mg时,下列说法不正确的是
2Mg↑+SiO2获取镁,每生成1mol Mg时,下列说法不正确的是
A.消耗的MgO质量为40gB.断裂Si-Si键的数目为NA
C.转移的电子数为2NAD.生成镁蒸气体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某水系锂离子电池可实现Li+和Co2+分离回收,其装置如图。25℃时,Co(OH)2的Ksp分别为6.31×10—15,LiOH的溶解度为12.7g.下列说法不正确的是
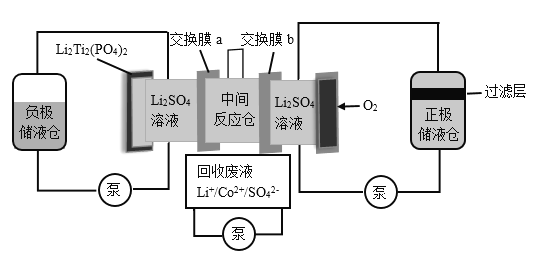
A.负极材料中发生变价的元素是Ti
B.交换膜a为阳离子交换膜
C.负极液和正极液中的c(Li+)均变大
D.在过滤层可收集到Co(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)![]() 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的( )
A.常温下,将 1mL pH=3 的醋酸溶液加水稀释到 100mL,测得其 PH<5
B.红棕色的 NO2,加压后颜色先变深后变浅
C.工业合成氨中通常采取高温及加入催化剂,提高生产效益
D.实验室制取氨气利用浓氨水和固体氢氧化钠混合的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2NNO2(硝酰胺,Nitrarnide)是一种弱酸,常温下Ka1=10-5.6。常温下,硝酰胺分解反应,H2NNO2(aq)=N2O(g)+H2O(l)的第-步为O2NNH2(aq)![]() O2NNH-(aq)+H+(aq),其中k为速率常数,υ正=k1c(O2NNH2),υ逆=k-1c(O2NNH-)·c(H+),则
O2NNH-(aq)+H+(aq),其中k为速率常数,υ正=k1c(O2NNH2),υ逆=k-1c(O2NNH-)·c(H+),则![]() 等于( )
等于( )
A.5.6B.8.4C.-5.6D.-8.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com