
| A. | 研制水溶剂涂料替代有机溶剂涂料 | |
| B. | 用可降解塑料生产包装盒或快餐盒 | |
| C. | 用反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O 制备硫酸铜 | |
| D. | 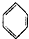 +CH2=CH2→ +CH2=CH2→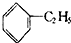 |
分析 绿色化学是指化学反应过程中以“原子经济性”为基本原则,即在获取新物质的化学反应中充分利用参与反应的每个原料原子,实现“零排放”.不仅充分利用资源,而且不产生污染.
解答 解:A、涂料中的有机溶剂主要是苯类、酯类醛类、醚类等,含有有害物质危害人的身体健康,研制水溶剂涂料替代有机溶剂涂料,减少有机溶剂的危害,符合绿色化学理念,故A不选;
B、可降解和可再利用的产品可减少白色污染,符合绿色化学理念,故B不选;
C、用浓硫酸和铜制备硫酸铜,反应过程中产生二氧化硫有害的气体污染大气,不符合绿色化学理念,故C选;
D、 +CH2=CH2→
+CH2=CH2→ 的反应无副产物生成,原子利用率达100%,符合绿色化学理念,故D不选.
的反应无副产物生成,原子利用率达100%,符合绿色化学理念,故D不选.
故选C.
点评 本题考查了绿色化学的理念在不同化学应用中的体现,关键是理解实质后来解决问题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl HCl H2O NaOH | B. | Cl2Na2S HCl CO2 | ||
| C. | HBr CCl4H2O CO2 | D. | Na2O2H2O2H2O O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 -C≡C-CH=CH-CH3,有关其结构说法正确的是( )
-C≡C-CH=CH-CH3,有关其结构说法正确的是( )| A. | 所有碳原子不可能在同一平面上 | B. | 所有碳原子可能在同一条直线上 | ||
| C. | 碳原子同一平面上至少有9个 | D. | 所有原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再发生变化 | |
| B. | 反应速率之比υ(N2):υ(H2):υ(NH3)=1:3:2 | |
| C. | 每生成3molH2的同时消耗2molNH3 | |
| D. | 每断裂1molN≡N键的同时断裂6molN-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原性二糖 | |
| B. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| C. | 纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体 | |
| D. | 已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol•L-1的AgNO3溶液和1×10-4 mol•L-1 K2CrO4溶液混合后会有Ag2CrO4沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
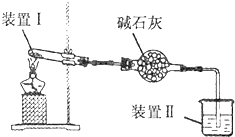 按如图所示装置进行实验,装置中现象II不正确的是( )
按如图所示装置进行实验,装置中现象II不正确的是( )| 选项 | 装置I中试剂 | 装置Ⅱ中试剂 | 装置Ⅱ中现象 |
| A | 浸透了石蜡油的石棉和碎瓷片 | 酸性高锰酸钾溶液 | 紫色溶液褪色 |
| B | 铁粉和用水浸泡的棉团 | 肥皂水 | 肥皂水冒泡 |
| C | 碳酸氢钠 | 澄清石灰水 | 有沉淀生成 |
| D | 硫酸铵 | 酚酞溶液 | 溶液变红 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com